题目内容
5.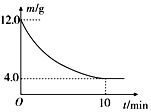 在一定的条件下,向2L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应时间与残留固体的质量关系如图所示. 下列说法正确的是( )
在一定的条件下,向2L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应时间与残留固体的质量关系如图所示. 下列说法正确的是( )| A. | 升高温度时,正反应速率增大,逆反应速率减小 | |
| B. | 随着反应的进行,混合气体的平均相对分子质量增大 | |
| C. | 增加硫酸镁的质量时,正反应速率将增大 | |
| D. | 在 0~10min内,v(CO)=0.01mol?L-1?min-1 |
分析 A.升高温度,正逆反应速率都增大;
B.反应生成的气体为二氧化碳、二氧化硫,相对分子质量都比CO大;
C.硫酸镁为固体,对反应速率无影响;
D.在 0~10min,固体质量由12.0g变为4.0g,可结合反应的方程式利用差量法计算.
解答 解:A.升高温度,正逆反应速率都增大,故A错误;
B.反应生成的气体为二氧化碳、二氧化硫,相对分子质量都比CO大,则随着反应的进行,混合气体的平均相对分子质量增大,故B正确;
C.加入固体,反应物浓度不变,反应速率不变,故C错误;
D.对于MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△m
120g 1mol 80g
x 12.0g-4.0g=8.0g
x=0.1mol,
则 0~10min内,v(CO)=$\frac{\frac{0.1mol}{2L}}{10min}$=0.005mol?L-1?min-1,故D错误.
故选B.
点评 本题考查图象分析以及化学平衡的计算,为高频考点,侧重考查学生分析能力和计算能力,注意把握影响化学反应速率的因素,难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
16.一定温度下,可逆反应N2+3H2?2NH3达到平衡的标志是( )
| A. | 2v正(H2)═3v逆(NH3) | B. | v正 (N2)═3v逆(H2) | ||
| C. | v正(N2)═v逆(NH3) | D. | N2、H2、NH3的体积比为1:3:2 |
17.下列有关化学用语表示正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 苯的实验式:CH | ||
| C. | CaC2的电子式: | D. | -CH2CH3的名称是乙烷 |
14.化学与生活密切相关,下列说法正确的是( )
| A. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| B. | 日常生活中,卤水点豆腐、花生中提取花生油、海水晒盐都是物理变化 | |
| C. | 食品保鲜膜、塑料水杯等生活用品的主要成分是聚氯乙烯 | |
| D. | 铝比铁活泼,所以一般情况下,铁制品比铝制品更耐腐蚀 |
1. 如图,曲线为可逆反应A(g)+2B(g)?2C(g) 正反应为吸热反应的平衡移动关系曲线,下列说法正确的是( )
如图,曲线为可逆反应A(g)+2B(g)?2C(g) 正反应为吸热反应的平衡移动关系曲线,下列说法正确的是( )
 如图,曲线为可逆反应A(g)+2B(g)?2C(g) 正反应为吸热反应的平衡移动关系曲线,下列说法正确的是( )
如图,曲线为可逆反应A(g)+2B(g)?2C(g) 正反应为吸热反应的平衡移动关系曲线,下列说法正确的是( )| A. | a<b,y轴指B的质量分数 | B. | a>b,y轴指C的质量分数 | ||
| C. | a<b,y轴指A的转化率 | D. | a>b,y轴指A的体积分数 |
10.为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.
供选择的化学试剂及实验方法:
A、酸性高锰酸钾,观察现象 B、滴加酚酞试液,观察现象
C、用淀粉碘化钾试纸,观察现象 D、加入NaOH浓溶液加热,观察现象.
| 实 验 目 的 | 试剂及方法 |
| 证明NaOH溶液具有碱性 | B |
| 鉴别Na2SO4溶液和(NH4)2SO4溶液 | D |
| 检验自来水中是否含有Cl2 | C |
| 区别CH4和C2H4两种无色气体 | A |
A、酸性高锰酸钾,观察现象 B、滴加酚酞试液,观察现象
C、用淀粉碘化钾试纸,观察现象 D、加入NaOH浓溶液加热,观察现象.
17.不符合工业治炼金属情况的是( )
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | 2MgO$\frac{\underline{\;\;△\;\;}}{\;}$2Mg+O2↑ | D. | MgCl2$\frac{\underline{\;电解\;}}{熔融}$Mg+Cl2↑ |
14.下列说法正确的是( )
| A. | 氢氧燃料电池工作时,H2在负极上失去电子 | |
| B. | 0.1mol/LNa2CO3溶液加热后,溶液的PH减小 | |
| C. | 中和滴定时,滴定管用所盛装的反应液润洗2〜3次 | |
| D. | 室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力增强 |
15.下列事实不能用电化学理论解释的是( )
| A. | 纯铁制品比钢铁制品更耐腐蚀 | |
| B. | 同种金属作为原电池的正极比作为电解池的阳极腐蚀得更慢 | |
| C. | 钢管镀锌时,锌棒做阳极,钢管做阴极,锌盐溶液做电解质溶液 | |
| D. | 铝片不用特殊方法保存 |