题目内容
20.用己知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确是( )| A. | 滴定前,没有逐出滴定管下口的气泡 | |
| B. | 用甲基橙作指示剂,指示剂刚变色,就停止滴定 | |
| C. | 酸式滴定管用蒸馏水洗净后,直接加入己知浓度的盐酸 | |
| D. | 锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
分析 根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A.滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析可知c(待测)偏大,故A错误;
B.应半分钟不变色为滴定中等,故B错误;
C.滴定前,没有逐出酸式滴定管尖嘴处的气泡,滴定终点时气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析可知c(待测)偏大,故C错误;
D.锥形瓶不需要润洗,可直接加入溶液,故D正确.
故选D.
点评 本题主要考查了中和滴定操作的误差分析,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析是解答的关键,题目难度中等.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
10.下列除去杂质(括号中的物质为杂质)的方法中,不正确的是( )
| A. | FeCl3溶液(FeCl2):通入适量Cl2 | |
| B. | Fe2O3固体(Al2O3):加入足量的盐酸,过滤 | |
| C. | CO气体(CO2):通过NaOH溶液洗气后干燥 | |
| D. | Cl2气体(HCl):通过饱和NaCl溶液洗气后干燥 |
11.下列各组离子,在强酸性溶液中可以大量共存的是( )
| A. | Mg2+、Fe3+、SCN-、Cl- | B. | Na+、K+、NO3-、Ba2+ | ||
| C. | Na+、K+、HCO3-、Cl- | D. | Fe2+、Ag+、I-、Cl- |
8.下列实验事实不能用基团间相互作用来解释的是( )
| A. | 与Na反应时,乙醇的反应速率比水慢 | |
| B. | 苯酚能与NaOH溶液反应而乙醇不能 | |
| C. | 乙醇能使重铬酸钾溶液褪色而乙酸不能 | |
| D. | 苯、甲苯发生硝化反应生成一硝基取代产物时,甲苯的反应温度更低 |
15.深海中存在可燃冰(CH4•nH2O固体).已知:CH4•nH2O(s)?CH4(g)+nH2O(l)-Q(Q>0)深海中能够存在可燃冰,是因为深海具有以下条件中的( )
| A. | 低温高压 | B. | 高温低压 | C. | 低温低压 | D. | 高温高压 |
5.下列有关实验的选项正确的是( )
| A. | 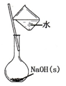 配置0.10mol/LnaOH溶液 | |
| B. | 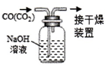 除去CO中的CO2 | |
| C. | 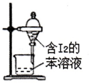 苯萃取碘水中的I2,分出水层后的操作 | |
| D. | 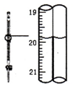 记录滴定终点读数为19.80mL |
12.对于方程式2H2S+O2→2S+2H2O和2H2S+SO2→3S↓+2H2O,所得结论中,正确的是( )
| A. | 化合价升降总数不等 | B. | 这两个反应的类型不相同 | ||
| C. | 产物种类相同 | D. | 硫元素价态变化相同 |
9.根据如图转化关系判断下列说法不正确的是( )


| A. | 反应Ⅰ中SO2是还原剂 | B. | 反应Ⅲ中H2是还原产物 | ||
| C. | 氧化性强弱顺序:H2SO4>I2>SO2 | D. | 该转化关系可实现分解H2O制取H2 |
18.下列叙述中正确的是( )
| A. | 油脂都不能使溴的四氯化碳溶液褪色 | |
| B. | 乙烯的结构简式可表示为CH2CH2 | |
| C. | 苯、乙醇和乙酸都可以发生取代反应 | |
| D. | 油脂皂化反应基本完成的现象是反应后静置,反应液分两层 |