题目内容
12.对于方程式2H2S+O2→2S+2H2O和2H2S+SO2→3S↓+2H2O,所得结论中,正确的是( )| A. | 化合价升降总数不等 | B. | 这两个反应的类型不相同 | ||
| C. | 产物种类相同 | D. | 硫元素价态变化相同 |
分析 2H2S+O2→2S+2H2O中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,所以属于氧化还原反应,转移电子数为4;
2H2S+SO2→3S↓+2H2O中S元素化合价由-2价、+4价变为0价,属于氧化还原反应,转移电子数为4,据此分析解答.
解答 解:2H2S+O2→2S+2H2O中S元素化合价由-2价变为0价、O元素化合价由0价变为-2价,所以属于氧化还原反应,转移电子数为4;
2H2S+SO2→3S↓+2H2O中S元素化合价由-2价、+4价变为0价,属于氧化还原反应,转移电子数为4,
A.根据以上分析知,化合价升降总数相等为4,故A错误;
B.这两个反应都有电子转移,所以都属于氧化还原反应,所以反应类型相同,故B错误;
C.根据方程式知,这两个反应产物种类相同,都是两种产物,故C正确;
D.根据以上分析知,第一个方程式S元素化合价由0价变为-2价,第二个方程式中S元素化合价由-2价、+4价变为0价,所以硫元素价态变化不同,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,明确氧化还原反应实质是解本题关键,其特征是元素化合价升降,注意第二个方程式中氧化产物和还原产物是同一种物质,题目难度不大.

练习册系列答案
相关题目
3.下列表示物质用途的化学方程式不正确的是( )
| A. | 用硅酸钠与盐酸反应制备硅胶:SiO32-+2H+═H2SiO3(胶体) | |
| B. | 用二氧化硅与烧碱反应制备硅酸钠:SiO2+OH-═SiO32-+H2O | |
| C. | 用铝热法炼铁:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| D. | 用氯气制备漂白粉:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O |
20.用己知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确是( )
| A. | 滴定前,没有逐出滴定管下口的气泡 | |
| B. | 用甲基橙作指示剂,指示剂刚变色,就停止滴定 | |
| C. | 酸式滴定管用蒸馏水洗净后,直接加入己知浓度的盐酸 | |
| D. | 锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
17.下列物质的转化中,只有加入酸才能一步实现的是( )
| A. | Fe→FeSO4 | B. | NaOH→NaCl | C. | CaO→CaSO4 | D. | CaCO3→CO2 |
4.对于常温下pH=12的氨水,下列说法正确的是( )
| A. | 向溶液中加入稀盐酸可以促进氨水的电离,溶液的碱性增强 | |
| B. | 向溶液中加入等体积的pH=2盐酸后溶液呈酸性 | |
| C. | 由水电离产生的c(OH-)=10-12mol•L-1 | |
| D. | 向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |
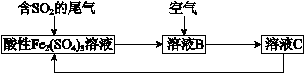
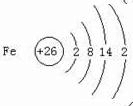 .与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O.
.与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为KOH+HBrO4=KBrO4+H2O.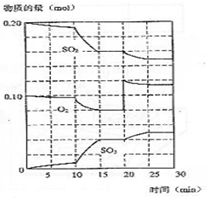 在一定条件下发生如下反应:2SO2(g)+O2 (g)?2SO3(g);△H<0
在一定条件下发生如下反应:2SO2(g)+O2 (g)?2SO3(g);△H<0