题目内容
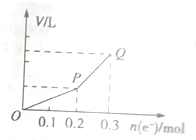 用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定).欲使溶液恢复到起始状态,可向溶液中加入( )| A、0.1molCuO |
| B、0.1molCuCO3 |
| C、0.1molCu(OH)2 |
| D、0.05molCu2(OH)2CO3 |
考点:电解原理
专题:
分析:用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜单质,当铜离子完全析出时,继续电解,阴极上氢离子放电生成氢气,根据“析出什么加入什么”的原则加入物质即可.
解答:
解:用惰性电极电解硫酸铜溶液时,先发生反应2CuSO4+2H2O
2Cu+O2↑+2H2SO4,当铜离子完全析出时,发生反应2H2O
2H2↑+O2↑,根据图象知,转移电子0.2mol时只有气体氧气生成,发生反应2CuSO4+2H2O
2Cu+O2↑+2H2SO4,实际上相当于析出氧化铜,根据氧化铜和转移电子之间的关系式得n(Cu)=
=0.1mol,所以相当于析出0.1molCuO;
继续电解发生的反应为2H2O
2H2↑+O2↑,实际上是电解水,根据水和转移电子之间的关系式得m(H2O)=
mol=0.25mol,所以电解水的质量是0.25mol,
根据“析出什么加入什么”的原则知,要使溶液恢复原状,应该加入0.1mol氧化铜和0.05mol水,
A.只加氧化铜不加水不能使溶液恢复原状,故A错误;
B.加入碳酸铜时,碳酸铜和稀硫酸反应生成硫酸铜和二氧化碳,所以相当于加入氧化铜,没有加入水,所以不能使溶液恢复原状,故B错误;
C.0.075mol Cu(OH)2相当于加入0.075molCuO和0.075molH2O,与析出物质的物质的量不同,所以不能恢复原状,故C错误;
D.0.05mol Cu2(OH)2CO3,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,根据原子守恒知,相当于加入0.1molCuO和0.05mol的水,所以能使溶液恢复原状,故D正确;
故选D.
| ||
| ||
| ||
| 0.2mol |
| 2 |
继续电解发生的反应为2H2O
| ||
| 0.3-0.2 |
| 4 |
根据“析出什么加入什么”的原则知,要使溶液恢复原状,应该加入0.1mol氧化铜和0.05mol水,
A.只加氧化铜不加水不能使溶液恢复原状,故A错误;
B.加入碳酸铜时,碳酸铜和稀硫酸反应生成硫酸铜和二氧化碳,所以相当于加入氧化铜,没有加入水,所以不能使溶液恢复原状,故B错误;
C.0.075mol Cu(OH)2相当于加入0.075molCuO和0.075molH2O,与析出物质的物质的量不同,所以不能恢复原状,故C错误;
D.0.05mol Cu2(OH)2CO3,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,根据原子守恒知,相当于加入0.1molCuO和0.05mol的水,所以能使溶液恢复原状,故D正确;
故选D.
点评:本题以电解原理为载体考查了物质间的反应,根据图象中转移电子确定析出物质,再结合“析出什么加入什么”的原则分析解答,易错选项是D,根据原子守恒将Cu2(OH)2CO3改写为2CuO.H2O.CO2来分析解答,题目难度中等.

练习册系列答案
相关题目
一定能在下列溶液中大量共存的离子组是( )
| A、c(H+)=1×10-2mol?L-1的溶液:Na+、NH4+、CO32-、SO42- |
| B、水电离产生的c(H+)=1×10-12mol/L溶液:Fe2+、Ca2+、I-、NO3- |
| C、含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
| D、能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32- |
 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时,pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时,pH变化曲线如图所示,下列判断正确的是( )| A、a、c两点溶液的导电能力相同 |
| B、a、b、c三点溶液中水的电离程度:a>b=c |
| C、用等浓度的NaOH溶液分别与等体积的b、c两点溶液恰好完全反应,消耗NaOH溶液的体积相等 |
| D、b点溶液中存在微粒浓度关系:c(H+)=c(OH-)+c(NH3?H2O) |
Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下用足量CO还原,得到金属混合物2.39g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5g白色沉淀,则a的数值为( )
| A、3.41 | B、3.21 |
| C、3.19 | D、3.59 |
区别三种无色溶液NaCl、NaBr、NaI可选用( )
| A、AgNO3溶液 |
| B、氯水和酒精 |
| C、溴水和CCl4 |
| D、碘水和汽油 |
a mol C2H2跟b mol H2在密闭容器中反应,当该可逆反应达到平衡时,生成c mol C2H4,将反应后的混合气体完全燃烧,生成CO2和H2O,所需要氧气的物质的量是( )
| A、(3a+b)mol | ||||
B、(
| ||||
C、(
| ||||
| D、(3a+b+2c)mol |