题目内容
1.将3.84g铜粉与一定质量的浓硝酸反应,当铜完全作用时,收集到气体2.24L(标准状况下),则所消耗硝酸的物质的量( )| A. | 0.24mol | B. | 0.22mol | C. | 0.16mol | D. | 0.1mol |
分析 铜与硝酸反应硝酸呈酸性和氧化性,所以所消耗硝酸的物质的量是两者之和.
解答 解:3.84g铜粉生成硝酸铜,要消耗2×$\frac{3.84}{64}$=0.12mol的硝酸;2.24L气体是NO和NO2的混合物,物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,也要消耗0.22mol的硝酸;则所消耗的硝酸为0.22mol,故选B.
点评 本题考查化学方程式的计算,难度不大,注意浓硝酸和稀硝酸的性质的不同,明确二氧化氮或一氧化氮和硝酸的关系以及铜与硝酸(表现酸性)的关系式是解本题的关键.

练习册系列答案
相关题目
2.pH=3的醋酸与同体积的pH=11的NaOH溶液,混合后( )
| A. | 等于7 | B. | 小于7 | C. | 大于7 | D. | 不能确定 |
16.两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应.同温同压下放出相同体积的气体,则消耗的盐酸与烧碱的物质的量之比为( )
| A. | 1:1 | B. | 2:3 | C. | 3:1 | D. | 1:6 |
6.科学家最近在-100℃的低温下合成了一种键线式为 的烃X,根据分析,下列说法中不正确的是( )
的烃X,根据分析,下列说法中不正确的是( )
 的烃X,根据分析,下列说法中不正确的是( )
的烃X,根据分析,下列说法中不正确的是( )| A. | X的分子式为C5H4 | |
| B. | 分子中氢原子的化学环境有2种 | |
| C. | 1 mol X在一定条件下可与2 mol氢气发生反应 | |
| D. | X不能使高锰酸钾酸性溶液褪色 |
10.下列说法错误的是( )
| A. | 向苦卤(含K+、Mg2+、Br-等)中通入Cl2是为了提取溴 | |
| B. | 粗盐(含Ca2+、Mg2+、SO42-、泥沙等杂质)可采用除杂和重结晶等过程提纯 | |
| C. | 海带提碘只涉及物理变化,海水提镁涉及复分解反应 | |
| D. | 富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 |
11.下列有关实验描述说法正确的是( )
| 选项 | 实验描述 |
| A | 将SO2通入到紫色石蕊溶液中,溶液先变红后褪色 |
| B | 将SO2通入到KMnO4(H+)溶液中,紫色褪去 |
| C | 将Cl2与SO2 按物质的量之比1:1混合后,通入到品红溶液中,红色褪去 |
| D | 将CO2通入BaCl2溶液,出现白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
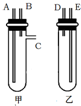 某兴趣小组要进行有关氢气的定量测定实验,为保证氢气不损失,设计用甲、乙两装置及橡胶管完成锌粒和稀硫酸制取氢气的操作.步骤如下:
某兴趣小组要进行有关氢气的定量测定实验,为保证氢气不损失,设计用甲、乙两装置及橡胶管完成锌粒和稀硫酸制取氢气的操作.步骤如下: