题目内容
如图各装置中,能形成原电池的是( )

| A、①中液体为FeCl3溶液 |
| B、②中液体为酒精 |
| C、③中液体为H2SO4溶液 |
| D、④中液体为稀盐酸 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,据此分析解答.
解答:
解:A.①中液体为FeCl3溶液,符合原电池的构成条件,所以能形成原电池,故A正确;
B.②中液体为酒精,不能自发的进行氧化还原反应,所以不能构成原电池,故B错误;
C.③中液体为H2SO4溶液,两个电极材料相同,所以不能构成原电池,故C错误;
D.④中液体为稀盐酸,该装置不能构成闭合回路,所以不能构成原电池,故D错误;
故选A.
B.②中液体为酒精,不能自发的进行氧化还原反应,所以不能构成原电池,故B错误;
C.③中液体为H2SO4溶液,两个电极材料相同,所以不能构成原电池,故C错误;
D.④中液体为稀盐酸,该装置不能构成闭合回路,所以不能构成原电池,故D错误;
故选A.
点评:本题考查了原电池原理,明确原电池构成条件是解本题关键,根据原电池构成条件分析解答即可,这几个条件必须同时具备,缺一不可,题目难度不大.

练习册系列答案
相关题目
一定条件下,在一密闭容器中将1.0mol/L N2与3.0mol/L H2合成氨,反应到2s时测得NH3的浓度为0.8mol/L,当用氢气浓度的减少来表示该反应的反应速率时,该反应的反应速率为( )
| A、0.2 mol/(L?s) |
| B、0.4 mol/(L?s) |
| C、0.6 mol/(L?s) |
| D、0.8 mol/(L?s) |
有一未知浓度的硫酸溶液25mL,在加入0.1mol/L BaCl2溶液10mL后,改加NaOH溶液,结果用去0.1mol/L NaOH溶液25mL恰好完全中和,则此硫酸的物质的量浓度为( )
| A、0.2 mol/L |
| B、0.5 mol/L |
| C、0.1 mol/L |
| D、0.05 mol/L |
下列说法正确的是( )
| A、氟氯烃是一类含氟和氯原子的卤代烃 |
| B、1-丁烯存在顺反异构 |
| C、1mol甲烷可与2mol Cl2完全取代生成CCl4 |
D、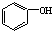 的结构中含有决定醇类性质的官能团--羟基 的结构中含有决定醇类性质的官能团--羟基 |
工业上用碳在高温下还原SiO2制取硅,如果将30g SiO2和足量的碳在高温下充分反应,则下列叙述中正确的是( )
| A、反应中生成了22.4L CO |
| B、反应中有12g碳被还原 |
| C、有0.5mol SiO2参加反应 |
| D、反应中有0.5×6.02×1023个电子发生转移 |
下列有关有机物的说法中正确的是( )
| A、凡是含碳元素的化合物都属于有机物 |
| B、易溶于汽油、酒精、苯等有机溶剂中的物质一定是有机物 |
| C、所有的有机物都很容易燃烧 |
| D、有机物不一定都不溶于水 |
无论是在水溶液中还是在熔融状态下均不导电的化合物为非电解质.下列各组物质中,前者属于电解质,后者属于非电解质的是( )
| A、NaCl溶液、CO2 |
| B、铜、蔗糖 |
| C、液态HCl、NH3 |
| D、汽油、硫酸溶液 |