题目内容
在生活、生产中为增大反应速率而采取的措施合理的是( )
| A、塑料制品中添加抑制剂 |
| B、食物放在冰箱中 |
| C、燃煤发电时用煤粉代替煤块 |
| D、在糕点包装内放置小包除氧剂 |
考点:化学反应速率的调控作用
专题:化学反应速率专题
分析:在工业生产中,为提高产量,可增大反应速率,为减小损耗,避免浪费,节约资源,应减少损耗的反应速率,结合影响化学反应速率的因素解答该题.
解答:
解:A.塑料制品中添加抑制剂,可减小塑料老化的速率,故A不选;
B.冰箱中温度较低,食物放在冰箱中,可减小食物腐败的速率,故B不选;
C.燃煤发电时用煤粉代替煤块,固体表面积增大,反应速率增大,故C选;
D.在糕点包装内放置小包除氧剂,可抑制糕点的氧化,防止变质,故D不选.
故选C.
B.冰箱中温度较低,食物放在冰箱中,可减小食物腐败的速率,故B不选;
C.燃煤发电时用煤粉代替煤块,固体表面积增大,反应速率增大,故C选;
D.在糕点包装内放置小包除氧剂,可抑制糕点的氧化,防止变质,故D不选.
故选C.
点评:本题考查化学反应速率的影响因素,为高考常见题型,侧重于考查学生的分析能力,有利于培养学生良好的科学素养,难度不大,注意化学反应速率对生活、生产的指导意义.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案
相关题目
能正确表示下列反应的离子方程式是( )
| A、硫酸铝溶液中加入过量氨水 Al3++3OH-=Al(OH)3↓ |
| B、碳酸钠溶液中加入少量稀盐酸 2 H++CO32-=CO2↑+H2O |
| C、用FeCL3溶液腐蚀铜板制印刷电路 2Fe3++Cu=2Fe2++Cu2+ |
| D、稀硫酸中加入铁粉 2Fe+6H+=2Fe3++3H2↑ |
下列有关表示正确的是( )
A、氯离子的结构示意图: |
B、氯化氢分子的电子式: |
| C、乙烯分子的结构式:CH2=CH2 |
D、苯分子的比例模型: |
2.24g铁屑与30mL 2mol/L盐酸充分反应后,溶液中FeCl2的物质的量是( )
| A、0.02 mol |
| B、0.03 mol |
| C、0.04mol |
| D、0.06 mol |
用食用白醋(醋酸浓度约为1mol/L)进行下列实验,能证明醋酸为弱电解质的是( )
| A、白醋中滴入石蕊试液呈红色 |
| B、白醋加入豆浆中有沉淀产生 |
| C、蛋壳浸泡在白醋中有气体放出 |
| D、白醋中c(H+)=0.01 moL/L |
下列物质中,既能与盐酸反应,又能与NaOH溶液反应的是( )
①NaHCO3 ②AgNO3③(NH4)2S ④HOOC-COONa⑤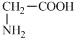 ⑥
⑥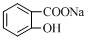
①NaHCO3 ②AgNO3③(NH4)2S ④HOOC-COONa⑤
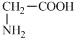 ⑥
⑥
| A、全部 | B、①②④⑤⑥ |
| C、②③④⑤⑥ | D、②④⑤⑥ |
除去食盐中混有的少量碘化钠杂质应采用的方法是( )
| A、加入AgNO3溶液后加热蒸干 |
| B、加入适量盐酸后加热蒸干 |
| C、加水溶解后通入适量氯气再加热蒸干 |
| D、加水溶解后滴入适量溴水再加热蒸干 |
下列各组中化合物的性质比较,不正确的是( )
| A、半径N>O>F |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、稳定性:PH3>H2S>HCl |
| D、酸性:HClO4>H2SO4>H2CO3 |
在离子RO3n-中,共有X个核外电子,R原子的质量数为A,则R原子核内含有的质子数目是( )
| A、A-X+n+48 |
| B、A-X+n+24 |
| C、A-X-n-24 |
| D、X-n-24 |