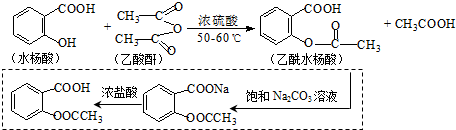
��Ŀ����
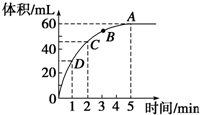 ����0.1mol��MnO2��ĩ��50mL�����������Һ�У��ܶ�Ϊ1.1g?mL-1�����ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ��ʾ���ش��������⣺
����0.1mol��MnO2��ĩ��50mL�����������Һ�У��ܶ�Ϊ1.1g?mL-1�����ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ��ʾ���ش��������⣺��1��A��B��C��D�ĵ㻯ѧ��Ӧ�����ɿ쵽����˳��Ϊ
��2�����ͷ�Ӧ���ʱ仯��ԭ��
��3�������������ij�ʼ���ʵ���Ũ�ȣ������������λ��Ч���֣�
��4����Ӧ���е�2����ʱ���������������������Ҫ��д������̣������������λ��Ч���֣���
���㣺���ʵ�����Ũ����ʱ��ı仯����,��ѧ��Ӧ���ʵ�Ӱ������
ר�⣺��ѧ��Ӧ����ר��
��������1������Ũ�ȶԷ�Ӧ���ʵ�Ӱ���ж�A��B��C��D���㷴Ӧ���ʴ�С��
��2�����ŷ�Ӧ�Ľ��У���Һ��Ũ�����ͣ���Ӧ������С��
��3�����ݷ���ʽ��������60ml��������Ĺ�����������ʵ�������������Ũ�ȣ�
��4�����ݷ���ʽ��������45ml��������Ĺ�����������ʵ������������Һ��ʣ��Ĺ������������Ȼ������������������������
��2�����ŷ�Ӧ�Ľ��У���Һ��Ũ�����ͣ���Ӧ������С��
��3�����ݷ���ʽ��������60ml��������Ĺ�����������ʵ�������������Ũ�ȣ�
��4�����ݷ���ʽ��������45ml��������Ĺ�����������ʵ������������Һ��ʣ��Ĺ������������Ȼ������������������������
���
�⣺��1����Ӧ��Ũ�ȴ�С������Ӧ���ʴ�С�����ŷ�Ӧ�Ľ��У�����������Һ��Ũ����С����Ӧ����Ҳ���ż�С��A��B��C��D�ĵ㻯ѧ��Ӧ�����ɿ쵽����˳��ΪD��C��B��A��
�ʴ�Ϊ��D��C��B��A��
��2��Ũ��Խ��Ӧ����Խ��֮ԽС�����ŷ�Ӧ���У���Ӧ���Ũ����С����������С��
�ʴ�Ϊ�����ŷ�Ӧ�Ľ��У�����������Һ��Ũ����С����Ӧ����Ҳ���ż�С��
��3�����ݷ���ʽ����
2H2O2
2H2O+O2��
2mol 22.4L
n��H2O2�� 0.06L
n��H2O2��=
=0.00536mol������c��H2O2��=
=0.107 mol?L-1��
�ʴ�Ϊ��0.107 mol?L-1��
��4����2minʱ��Ӧ���ĵĹ�������Ϊxmol��
2H2O2
2H2O+O2��
2mol 22.4L
x 0.045L
n��H2O2��=
=0.00402mol��
��2minʱ��Һ��ʣ��Ĺ�������Ϊ0.00536mol-0.00402mol=0.00134mol����m��H2O2��=nM=0.00134mol��34g/mol=0.04556g�����ɵ�����������Ϊm=0.00402��
��32=0.06432g����Ӧ���е�2����ʱ�����������������Ϊ��
��100%=0.083%��
�𣺷�Ӧ���е�2����ʱ�����������������Ϊ0.083%��
�ʴ�Ϊ��D��C��B��A��
��2��Ũ��Խ��Ӧ����Խ��֮ԽС�����ŷ�Ӧ���У���Ӧ���Ũ����С����������С��
�ʴ�Ϊ�����ŷ�Ӧ�Ľ��У�����������Һ��Ũ����С����Ӧ����Ҳ���ż�С��
��3�����ݷ���ʽ����
2H2O2
| ||
2mol 22.4L
n��H2O2�� 0.06L
n��H2O2��=
| 2mol��0.06L |
| 22.4L |
| 0.00536mol |
| 0.05L |
�ʴ�Ϊ��0.107 mol?L-1��
��4����2minʱ��Ӧ���ĵĹ�������Ϊxmol��
2H2O2
| ||
2mol 22.4L
x 0.045L
n��H2O2��=
| 2mol��0.045L |
| 22.4L |
��2minʱ��Һ��ʣ��Ĺ�������Ϊ0.00536mol-0.00402mol=0.00134mol����m��H2O2��=nM=0.00134mol��34g/mol=0.04556g�����ɵ�����������Ϊm=0.00402��
| 1 |
| 2 |
��32=0.06432g����Ӧ���е�2����ʱ�����������������Ϊ��
| 0.04556 |
| 50��1.1-0.06432 |
�𣺷�Ӧ���е�2����ʱ�����������������Ϊ0.083%��
���������⿼���������ֽ���������ߣ���Ŀ�Ѷ��еȣ���Ҫ����Ũ�ȶԷ�Ӧ���ʵ�Ӱ�졢�йط���ʽ�ļ���ȣ���ȷ����ͼ������߱仯�ǽ����Ĺؼ���

��ϰ��ϵ�д�
�����Ŀ
���и�����������Һ�п��Դ���������ǣ�������
| A��H+��CO32-��NO3-��SO42- |
| B��Ba2+��Cl-��NO3-��CO32- |
| C��Cu2+��H+��SO42-��Cl- |
| D��Ag+��OH-��CO32-��H+ |