题目内容
对于可逆反应:2A(g)+3B(g)?xC(g)+D(g),已知A和B的起始浓度分别为5mol?L-1和3mol?L-1,反应开始到达平衡的时间是2min,C的反应速率为0.5mol?L-1?min-1,平衡时D的浓度为0.5mol?L-1.求:
(1)x= ;
(2)B的平衡浓度为 ;
(3)A的转化率为 ;
(4)平衡混合气中C的体积分数 .
(1)x=
(2)B的平衡浓度为
(3)A的转化率为
(4)平衡混合气中C的体积分数
考点:化学平衡的计算
专题:化学平衡专题
分析:根据化学反应速率之比等于系数之比,结合化学反应的三行式:初始浓度、变化浓度、末态浓度进行计算即可,化学反应速率v=
,平衡浓度 c=
,转化率=
×100%,体积分数=
×100%.
| △c |
| △t |
| n |
| V |
| 消耗量 |
| 起始量 |
| 平衡混合气体中C的物质的量 |
| 平衡混合气体物质的量总和 |
解答:
解:依据化学平衡三段式列式计算
2A(g)+3B(g)?xC(g)+D(g)
初始浓度(mol/L) 5 3 0 0
转化浓度(mol/L) 1 1.5 0.5x 0.5
2min浓度(mol/L) 4 1.5 0.5x 0.5
(1)C的反应速率为
mol/L=0.5mol/(L?min),解得x=2,故答案为:2;
(2)依据上述计算可知,2min末时,B的浓度=1.5mol/L,故答案为:1.5mol/L;
(3)2min末时,A的转化率=
×100%=20%,故答案为:20%;
(4)平衡混合气中C的体积分数=
×100%=14.3%,故答案为:14.3%.
2A(g)+3B(g)?xC(g)+D(g)
初始浓度(mol/L) 5 3 0 0
转化浓度(mol/L) 1 1.5 0.5x 0.5
2min浓度(mol/L) 4 1.5 0.5x 0.5
(1)C的反应速率为
| 0.5xmol/L |
| 2min |
(2)依据上述计算可知,2min末时,B的浓度=1.5mol/L,故答案为:1.5mol/L;
(3)2min末时,A的转化率=
| 1mol/L |
| 5mol/L |
(4)平衡混合气中C的体积分数=
| 0.5×2 |
| 4+1.5+0.5×2+0.5 |
点评:本题考查学生有关化学平衡和化学反应速率的有关计算知识,属于考查的重点内容,注意三行式在解题中的灵活应用,难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、在100℃、101kPa条件下,液态水的气化热为40.69kJ?mol-1,则H2O(g)?H2O(l)的△H=40.69kJ?mol-1 |
| B、在PH=2的盐酸中,水电离出来的c(OH-)=1.0×10-12mol?L-1 |
| C、CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)的△H=2×(-283.0)kJ?mol-1 |
| D、常温下,在0.10mol?L-1的NH3?H2O溶液中加入少量NH4Cl晶体,能使NH3?H2O的电离度降低,溶液的pH减小 |

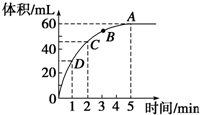 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为1.1g?mL-1),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为1.1g?mL-1),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
 X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体.请回答下列问题(涉及物质均用化学式表示).
X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体.请回答下列问题(涉及物质均用化学式表示).