题目内容
t℃时,将2mol A和1mol B通入体积为2L的密闭容器中(容积不变),发生如下反应,A(g)+2B(g)?xC(g),2分钟后反应达到平衡状态,剩余了0.6molB,并测得C的浓度是0.3mol/L.请填写下列空白:
(1)从反应开始至平衡状态,A的平均反应速率为 .
(2)x=
(3)若向容器中通入少量氦气,化学平衡(填字母) .
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入2mol A和1mol B,在t℃下达到新的平衡,此时B的物质的量为:n(B)= mol.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,则起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 .
(1)从反应开始至平衡状态,A的平均反应速率为
(2)x=
(3)若向容器中通入少量氦气,化学平衡(填字母)
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(4)若向原平衡混合物的容器中再充入2mol A和1mol B,在t℃下达到新的平衡,此时B的物质的量为:n(B)=
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,则起始加入三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)依据化学反应速率的概念分析计算;
(2)依据平衡三段式列式计算;
(3)恒温恒容容器中加入氦气是惰性气体,增大体系压强,各气体分压不变,平衡不变;
(4)若向原平衡混合物的容器中再充入2mol A和1mol B,相当于增大压强,反应前后气体体积不变平衡不动;反应物的转化率不变,依据(2)计算得到;
(5)依据化学反应达到平衡时“等量等效”的方法分析计算满足的关系.
(2)依据平衡三段式列式计算;
(3)恒温恒容容器中加入氦气是惰性气体,增大体系压强,各气体分压不变,平衡不变;
(4)若向原平衡混合物的容器中再充入2mol A和1mol B,相当于增大压强,反应前后气体体积不变平衡不动;反应物的转化率不变,依据(2)计算得到;
(5)依据化学反应达到平衡时“等量等效”的方法分析计算满足的关系.
解答:
解:(1)平衡时B的变化浓度=
=0.2mol/L,依据化学反应速率概念计算得到:B的反应速率=
=0.1mol/L?min,化学反应速率之比等于化学方程式计量数之比,V(A)=
V(B)=0.05mol/L?min;故答案为:0.05mol/L?min;
(2)t℃时,将2mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:A(g)+2B(g)?xC(g),2min时反应达到平衡状态(温度不变),剩余了0.6mol B,并测得C的浓度为0.3mol/L物质的量为0.6mol,
A(g)+2B(g)?xC(g),
起始量(mol) 2 1 0
变化量(mol) 0.2 0.4 0.6
平衡量(mol) 1.8 0.6 0.6
1:x=0.2:0.6=1:3,x=3
故答案为:3;
(3)恒温恒容容器中加入氦气是惰性气体,增大体系压强,各气体分压不变,平衡不变,故答案为:C;
(4)若向原平衡混合物的容器中再充入2mol A和1mol B,在t℃时达到新的平衡,反应前后气体体积不变,向原平衡混合物的容器中再充入2mol A和1mol B,相当于增大压强平衡不动;反应物的转化率不变,则此时B的物质的量为n(B)=0.6mol×2=1.2mol,
故答案为:1.2;
(5)在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C),转化为起始量和原平衡相同;
A(g)+2B(g)?3C(g)
起始量 2 1 0
n(A) n(B) n(C)
转化起始量 n(A)+
n(C) n(B)+
n(C) 0
n(A)+
n(C)=2
n(B)+
n(C)=1
n(A)=2n(B),n(C)>0或n(A)+
n(C)=2[n(B)+
n(C)]
故答案为:n(A)=2n(B),n(C)>0或n(A)+
n(C)=2[n(B)+
n(C)].
| 1mol-0.6mol |
| 2L |
| 0.2mol/L |
| 2L |
| 1 |
| 2 |
(2)t℃时,将2mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:A(g)+2B(g)?xC(g),2min时反应达到平衡状态(温度不变),剩余了0.6mol B,并测得C的浓度为0.3mol/L物质的量为0.6mol,
A(g)+2B(g)?xC(g),
起始量(mol) 2 1 0
变化量(mol) 0.2 0.4 0.6
平衡量(mol) 1.8 0.6 0.6
1:x=0.2:0.6=1:3,x=3
故答案为:3;
(3)恒温恒容容器中加入氦气是惰性气体,增大体系压强,各气体分压不变,平衡不变,故答案为:C;
(4)若向原平衡混合物的容器中再充入2mol A和1mol B,在t℃时达到新的平衡,反应前后气体体积不变,向原平衡混合物的容器中再充入2mol A和1mol B,相当于增大压强平衡不动;反应物的转化率不变,则此时B的物质的量为n(B)=0.6mol×2=1.2mol,
故答案为:1.2;
(5)在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C),转化为起始量和原平衡相同;
A(g)+2B(g)?3C(g)
起始量 2 1 0
n(A) n(B) n(C)
转化起始量 n(A)+
| 1 |
| 3 |
| 2 |
| 3 |
n(A)+
| 1 |
| 3 |
n(B)+
| 2 |
| 3 |
n(A)=2n(B),n(C)>0或n(A)+
| 1 |
| 3 |
| 2 |
| 3 |
故答案为:n(A)=2n(B),n(C)>0或n(A)+
| 1 |
| 3 |
| 2 |
| 3 |
点评:本题考查了化学平衡的计算应用,影响平衡因素的理解应用,等效平衡的计算判断,题目难度中等.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
下列各组中的离子,能在强酸性溶液中大量共存的是( )
| A、Mg2+、SO42-、K+ |
| B、CO32-、Na+、NO3- |
| C、Al3+、CO32-、OH- |
| D、NO3-、Ag+、Cl- |
在下列各组物质中,分子数相同的一组是( )
| A、2L一氧化碳和2L二氧化碳 |
| B、18g水和标准状况下22.4L二氧化碳 |
| C、标准状况下22.4L水和lmol氧气 |
| D、0.2mol氢气和2.24L氯化氢气体 |
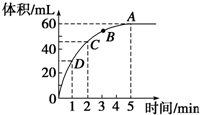 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为1.1g?mL-1),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为1.1g?mL-1),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
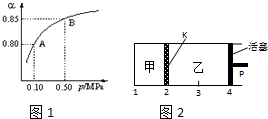 硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.
硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一.