题目内容
15.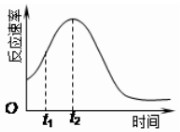 某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:….
(1)猜想Ⅱ可能是:生成的Mn2+在反应中起到催化剂的作用,加快了反应速率
(2)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容.
| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4,少量MnSO4(s)固体(填物质名称) |
| 实验现象(褪色时间) | 褪色时间10min | 褪色时间<10min(选填“<”“>”或“=”) |
| 结论 | 猜想Ⅱ正确 | |
分析 (1)猜想II是认为生成的Mn2+在反应中起到催化剂的作用,故应补充MnSO4,通过测量溶液褪色的时间来验证猜想;
(2)要通过对比实验来验证猜想Ⅱ,则实验B和实验A的加入试剂除了MnSO4固体不同,其他均应相同,据此分析.
解答 解:(1)根据反应速率的影响因素知,可能是反应生成的Mn2+起了催化作用,从而使反应速率加快;
故答案为:生成的Mn2+在反应中起到催化剂的作用,加快了反应速率;
(2)猜想Ⅱ成立,即Mn2+在反应中起到催化剂的作用,从而加快了反应速率,所以和设计方案进行实验,要进行一组对比实验,一支试管A中仅仅2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4,另外一支试管B中加入2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4,少量MnSO4(s),根据溶液褪色的快慢来判断Mn2+在反应中是否起到催化剂的作用,若猜想Ⅱ成立,褪色时间小于10min,
故答案为:MnSO4(s);<.
点评 本题考查了探究外界条件对化学反应速率的影响,明确要验证一个因素的改变对反应速率的影响,则必须保持其他影响因素一致,难度中等,平时重视基础知识很重要.

练习册系列答案
相关题目
6.X、Y、Z、W是原子序数依次增大的短周期主族元素,X与Z同主族,X原子的最外层电子数是其电子数的$\frac{2}{3}$,Y和W是同一周期中原子半径相差最大两种元素.下列叙述正确的是( )
| A. | 原子半径:W>Z | |
| B. | X、Y 均能与W形成的离子化合物 | |
| C. | Z、W的气态氢化物的稳定性:Z>W | |
| D. | X、Z的最高价氧化物的水化物酸性:X>Z |
3.铁矿石(主要成份FeS)与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为4:1:4时,实际参加反应的FeS与HNO3的物质的量之比为( )
| A. | 16:25 | B. | 1:7 | C. | 1:6 | D. | 2:11 |
20.下列有关溶液中的离子平衡的有关叙述中,正确的是( )
| A. | 一定温度下,向0.1mol/L的醋酸中滴加相同浓度的氨水,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$一直减小 | |
| B. | 已知Ksp(BaSO4)=1.07×10-30,Ksp(BaCO3)=2.58×10-9,所以不能将BaSO4转化为BaCO3 | |
| C. | 用弱酸溶液滴定强碱溶液时可用甲基橙作指示剂 | |
| D. | 已知电离常数HCN:Ka=4.9×10-10,H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11,则KCN溶液中通入少量CO2时的离子方程式为2CN-+H2O+CO2═2HCN+CO32- |
7.下列气体中,不能用启普发生器制取的是( )
| A. | 硫化氢 | B. | 二氧化硫 | C. | 二氧化碳 | D. | 氢气 |
5.有盐酸和醋酸两种溶液,c(Cl-)═c(CH3COO-),下列叙述正确的是( )
| A. | 醋酸溶液的pH大于盐酸 | |
| B. | 醋酸溶液的pH小于盐酸 | |
| C. | 分别用水稀释相同倍数后,所得溶液中:c(Cl-)═c(CH3COO-) | |
| D. | 两种溶液中水的电离程度相同 |

