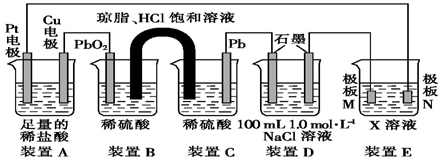
题目内容
13.下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是(已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(AgBr)=7.7×10-13)( )| A. | AgCl>AgI>AgBr | B. | AgCl>AgBr>AgI | C. | AgBr>AgCl>AgI | D. | AgBr>AgI>AgCl |
分析 c(Ag+)=$\sqrt{Ksp}$,结合Ksp(AgCl)=1.8×10-10、Ksp(AgI)=1.5×10-16、Ksp(AgBr)=7.7×10-13计算.
解答 解:由Ksp(AgCl)=1.8×10-10、Ksp(AgI)=1.5×10-16、Ksp(AgBr)=7.7×10-13可知,c(Ag+)=$\sqrt{Ksp}$,Ksp(AgI)最小,则c(Ag+)最小,Ag+浓度大小顺序为AgCl>AgBr>AgI,
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握银离子浓度与Ksp的关系为解答的关键,侧重分析与计算能力的考查,注意Ksp的应用,题目难度不大.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
10.某化学小组用如图所示的装置制取氯气,下列说法不正确的是( )
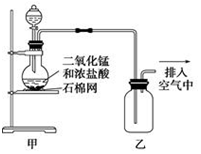

| A. | 该装置图中至少存在两处明显错误 | |
| B. | 在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 | |
| C. | 烧瓶中的MnO2可换成KMnO4 | |
| D. | 在集气瓶的导管口处放一片湿润的淀粉--KI试纸可以证明是否有氯气逸出 |
11.某酸件废水可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO32-、SO42-.取废水祥品分别进行如右图所示①~④四个实验.下列推断正确的是( )
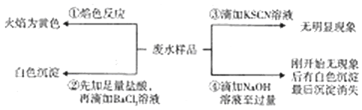

| A. | 废水含有Na+,不含K+ | B. | 废水含有SO42-和CO32- | ||
| C. | 废水不含Fe3+,可能含Fe2+ | D. | 废水一定含有Na+、Al3+、SO42-. |
18.下列说法正确的是( )
| A. | 甲烷的标准燃烧热为△H=-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 已知H2O(l)=H2O(g)△H=+44 kJ/mol,则2gH2(g)完全燃烧生成液态水比生成气态水多释放22kJ的热量 | |
| C. | 硝酸铵溶于水温度降低,这个过程发生的是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下△H的相同 |
2.在100mL 0.5mol/L AlCl3溶液中,加入100mL NaOH 溶液,得到2.34g 沉淀.则NaOH溶液物质的量浓度是(单位:mol/L)( )
| A. | 0.6 | B. | 0.9 | C. | 1.6 | D. | 1.7 |
3.酸雨的形成主要是由于( )
| A. | 森林遭到乱砍滥伐 | B. | 含硫化石燃料的大量燃烧 | ||
| C. | 大气中二氧化碳的含量增大 | D. | 含氮、磷的废水任意排放 |
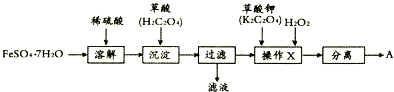
 某化学创新实验小组设计如图示实验装置来制取溴苯并证明该反应为取代反应.已知:溴苯的熔点为?30.8℃,沸点156℃.
某化学创新实验小组设计如图示实验装置来制取溴苯并证明该反应为取代反应.已知:溴苯的熔点为?30.8℃,沸点156℃. ;
;