题目内容
根据下面信息,判断下列叙述中正确的是( )


| A、1mol H2和0.5mol O2所具有的总能量低于1mol气态H2O所具有的总能量 | ||
| B、氢气跟氧气反应生成水的同时吸收能量 | ||
C、1mol H2跟
| ||
| D、2mol H2(g)跟1mol O2(g)反应生成2mol H2O(g)释放能量490kJ |
考点:化学反应中能量转化的原因
专题:化学反应中的能量变化
分析:反应物总能量大于生成物总能量反应放热;反应物总能量小于生成物总能量反应吸热;
化学反应中断键需要吸收能量,成键需要释放能量.当断键吸收的能量大于成键释放的能量,反应为放热反应,当断键吸收的能量小于成键释放的能量,反应为放热反应,据此解答.
化学反应中断键需要吸收能量,成键需要释放能量.当断键吸收的能量大于成键释放的能量,反应为放热反应,当断键吸收的能量小于成键释放的能量,反应为放热反应,据此解答.
解答:
解:依据反应的热效应=反应物键能之和-生成物的键能之和=436KJ+249KJ-930KJ=-245KJ;所以反应是放热反应;热化学方程式为:H2(g)+1/2O2(g)=H2O(g)△H=-245KJ/mol
A.氢气与氧气反应生成水是放热反应,根据能量守恒,所以反应物总能量大于生成物增能量,故A错误;
B.氢气与氧气反应生成水是放热反应,根据能量守恒,该反应的反应物的总能量大于生成物的总能量,故B错误;
C.1molH2(g)与0.5molO2(g)反应生成1molH2O(g),释放能量245KJ,气态水变为液态水时放出热量,所以1molH2(g)与0.5molO2(g)反应生成1molH2O(l),释放能量大于245KJ,题干中未说明水的聚集状态,无法判断放出的热量,故C错误;
D.依据反应的热化学方程式H2(g)+1/2O2(g)=H2O(g)△H=-245KJ/mol,可知同乘以2得到2H2(g)+O2(g)=2H2O(g)△H=-490KJ/mol,故D正确;
故选D.
A.氢气与氧气反应生成水是放热反应,根据能量守恒,所以反应物总能量大于生成物增能量,故A错误;
B.氢气与氧气反应生成水是放热反应,根据能量守恒,该反应的反应物的总能量大于生成物的总能量,故B错误;
C.1molH2(g)与0.5molO2(g)反应生成1molH2O(g),释放能量245KJ,气态水变为液态水时放出热量,所以1molH2(g)与0.5molO2(g)反应生成1molH2O(l),释放能量大于245KJ,题干中未说明水的聚集状态,无法判断放出的热量,故C错误;
D.依据反应的热化学方程式H2(g)+1/2O2(g)=H2O(g)△H=-245KJ/mol,可知同乘以2得到2H2(g)+O2(g)=2H2O(g)△H=-490KJ/mol,故D正确;
故选D.
点评:本题考查了反应的热效应的计算依据和判断方法,解题关键抓住反应热=反应物总键能-生成物总键能,题目难度中等.

练习册系列答案
相关题目
下列有机物命名正确的是( )
A、 ,2-乙基丙烷 ,2-乙基丙烷 |
| B、(CH3)2CH-异丙基 |
C、 间二甲苯 间二甲苯 |
D、 2-甲基-2-丙烯 2-甲基-2-丙烯 |
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).能判断该反应是否达到化学平衡状态的依据是( )
| A、容器中压强不变 |
| B、单位时间内消耗了n mol CO2,同时生成了n mol H2O |
| C、v正(H2)=v逆(H2O) |
| D、c(CO2)=c(CO) |
某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为3:1.用石墨作电极电解该混合溶液时,根据电极产物,可明显分为三个阶段.下列叙述不正确的是( )
| A、阴极自始自终只析出H2 |
| B、阳极先析出O2,后析出C12 |
| C、电解最后阶段为电解水 |
| D、溶液pH不断增大,最后为7 |
可逆反应A(g)+2B(g)?3C(g)+4D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
| A、v(A)=0.15 mol/(L?min ) |
| B、v(B)=0.5 mol/(L?min) |
| C、v(C)=0.4 mol/(L?min) |
| D、v(D)=0.02 mol/(L?s) |
磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在55~36nm的磁流体.下列说法中正确的是( )
| A、所得的分散系属于悬浊液 |
| B、该分散系能产生丁达尔效应 |
| C、所得的分散系中分散质为Fe2O3 |
| D、给分散系通电,不会出现任何变化 |
戊烷(C5H12)的同分异构体共有( )个.
| A、2个 | B、3个 | C、4个 | D、5个 |

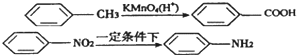
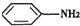 (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化)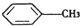 与浓硫酸、浓硝酸混合在不同温度下会得到不同产物.
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物.