题目内容
下列有关某无色溶液中所含离子的检验,判断正确的是( )
| A、加入AgNO3溶液,生成白色沉淀,加入稀盐酸沉淀不溶解,可确定有Cl-存在 |
| B、加入稀盐酸,产生的气体能使澄清石灰水变浑浊,可确定有CO32-存在 |
| C、加入BaCl2溶液产生白色沉淀,再加入足量稀盐酸沉淀不溶解,确定有SO42-存在 |
| D、加入BaCl2溶液产生白色沉淀,加入稀硝酸沉淀溶解,并产生无色无味气体,且能使澄清石灰水变浑浊,确定含有CO32-离子 |
考点:常见阴离子的检验
专题:
分析:A、根据加HCl之前生成的可能是AgCl沉淀,也可能是别的白色沉淀,但是后面加上HCl中含有大量Cl-离子,所以不能确定Cl-离子是原溶液里的还是后来加进去的;
B、能使石灰水变浑浊的气体可能是二氧化碳或二氧化硫,故溶液中的离子可能是CO32-、HCO3-,或SO32-、HSO3-;
C、不溶于盐酸的沉淀除了BaSO4,还有AgCl;
D、加入BaCl2溶液产生白色沉淀,此白色沉淀可能是BaSO4或AgCl或BaSO3或BaCO3,根据加入稀硝酸沉淀溶解并产生无色无味气体,且能使澄清石灰水变浑浊来分析.
B、能使石灰水变浑浊的气体可能是二氧化碳或二氧化硫,故溶液中的离子可能是CO32-、HCO3-,或SO32-、HSO3-;
C、不溶于盐酸的沉淀除了BaSO4,还有AgCl;
D、加入BaCl2溶液产生白色沉淀,此白色沉淀可能是BaSO4或AgCl或BaSO3或BaCO3,根据加入稀硝酸沉淀溶解并产生无色无味气体,且能使澄清石灰水变浑浊来分析.
解答:
解:A、因加HCl之前生成的可能是AgCl沉淀,也可能是别的白色沉淀,但是后面加上HCl中含有大量Cl-离子,所以不能确定Cl-离子是原溶液里的还是后来加进去的,故A错误;
B、能使石灰水变浑浊的气体可能是二氧化碳或二氧化硫,故溶液中的离子可能是CO32-、HCO3-,或SO32-、HSO3-,故B错误;
C、不溶于盐酸的沉淀除了BaSO4,还有AgCl,即加入BaCl2溶液产生白色沉淀,再加入足量稀盐酸沉淀不溶解,此白色沉淀可能是BaSO4,还可能是AgCl,故不能确定含不含SO42-,还可能含Ag+,故C错误;
D、加入BaCl2溶液产生白色沉淀,此白色沉淀可能是BaSO4或AgCl或BaSO3或BaCO3,加入稀硝酸沉淀溶解,故不能是BaSO4或AgCl,并产生无色无味气体,且能使澄清石灰水变浑浊,故不能是BaSO3,故是BaCO3,故一定含CO32-,故D正确.
故选D.
B、能使石灰水变浑浊的气体可能是二氧化碳或二氧化硫,故溶液中的离子可能是CO32-、HCO3-,或SO32-、HSO3-,故B错误;
C、不溶于盐酸的沉淀除了BaSO4,还有AgCl,即加入BaCl2溶液产生白色沉淀,再加入足量稀盐酸沉淀不溶解,此白色沉淀可能是BaSO4,还可能是AgCl,故不能确定含不含SO42-,还可能含Ag+,故C错误;
D、加入BaCl2溶液产生白色沉淀,此白色沉淀可能是BaSO4或AgCl或BaSO3或BaCO3,加入稀硝酸沉淀溶解,故不能是BaSO4或AgCl,并产生无色无味气体,且能使澄清石灰水变浑浊,故不能是BaSO3,故是BaCO3,故一定含CO32-,故D正确.
故选D.
点评:本题考查物质的检验和鉴别实验方案的设计,为高频考点,把握离子的检验方法、试剂及现象与结论为解答的关键,侧重离子检验的考查,注意检验应排除干扰离子,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
国际巴黎车展示上,世界各大汽车商纷纷推出环保动力小汽车,使用的新型环保电池为( )
| A、氢氧燃料电池 | B、锌锰电池 |
| C、镍镉电池 | D、铅蓄电池 |
实验中需1mol/L的NaOH溶液950mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是( )
| A、1000mL,38.0g |
| B、1000mL,40.0g |
| C、任意规格,38.0g |
| D、500mL,20.0g |
下列说法正确的是( )
| A、用氨水鉴别Al3+、Mg2+、Ag+ |
| B、向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为血红色,该溶液中不一定含有Fe2+ |
| C、NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用烧碱溶液就可把它们鉴别开来 |
| D、要证明Fe3+溶液中含有Fe2+可以用NH4SCN溶液和氯水 |
下列分子式只能表示一种物质的是( )
| A、C3H6Cl2 |
| B、C3H8 |
| C、C2H6O |
| D、C8H10 |
把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于两溶液的体积之和).向混合溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余.此时,溶液中的Fe2+物质的量浓度为( )
| A、0.5 mol/L |
| B、1.5 mol/L |
| C、1.0 mol/L |
| D、2mol/L |
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量).下列判断正确的是( )

| A、若T2>T1,达到平衡时b、d点的反应速率为vd>vb |
| B、若T2>T1,则正反应一定是放热反应 |
| C、达到平衡时A2的转化率大小为b>a>c |
| D、在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a |
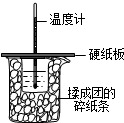 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: