题目内容
把2.0mol/LCuSO4溶液和1.0mol/LH2SO4溶液等体积混合(假设混合后溶液的体积等于两溶液的体积之和).向混合溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余.此时,溶液中的Fe2+物质的量浓度为( )
| A、0.5 mol/L |
| B、1.5 mol/L |
| C、1.0 mol/L |
| D、2mol/L |
考点:有关混合物反应的计算
专题:
分析:向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-),以此解答该题.
解答:
解:把2.0mol?L-1CuSO4和1.0mol?L-1H2SO4溶液等体积混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=
×2.0mol/L=1.0 mol/L,c(H2SO4)=
×1.0mol/L=0.5mol/L,
混合后溶液中硫酸根来源于硫酸铜与硫酸电离,故c(SO42-)=c(CuSO4)+c(H2SO4)=1mol/L+0.5mol/L=1.5mol/L,
向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=1.5mol/L,
故选B.
| 1 |
| 2 |
| 1 |
| 2 |
混合后溶液中硫酸根来源于硫酸铜与硫酸电离,故c(SO42-)=c(CuSO4)+c(H2SO4)=1mol/L+0.5mol/L=1.5mol/L,
向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=1.5mol/L,
故选B.
点评:本题考查物质的量浓度的有关计算,比较基础,注意对公式的理解与灵活运用,注意理解稀释定律.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
某烃完全燃烧生成二氧化碳和水的物质的量之比为1:1,在标准状况下的密度为2.5g/L,其分子式为( )
| A、C2H4 |
| B、C4H8 |
| C、C4H10 |
| D、C5H10 |
下列有关某无色溶液中所含离子的检验,判断正确的是( )
| A、加入AgNO3溶液,生成白色沉淀,加入稀盐酸沉淀不溶解,可确定有Cl-存在 |
| B、加入稀盐酸,产生的气体能使澄清石灰水变浑浊,可确定有CO32-存在 |
| C、加入BaCl2溶液产生白色沉淀,再加入足量稀盐酸沉淀不溶解,确定有SO42-存在 |
| D、加入BaCl2溶液产生白色沉淀,加入稀硝酸沉淀溶解,并产生无色无味气体,且能使澄清石灰水变浑浊,确定含有CO32-离子 |
对下列实验操作和事实的解释正确的是( )
| A、某学生用pH试纸测新制氯水的pH值,先变红后褪色,是因为Cl2有强氧化性 |
| B、向氯水中加入碳酸氢钠粉末,有气泡产生,说明氯水中含有H+ |
| C、配制一定物质的量浓度的溶液发现浓度偏低,可能由于配制溶液所用的容量瓶事先未干燥 |
| D、将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
在H2SO4、Ba(NO3)2、Na2CO3和AgNO3溶液中,首先被鉴别出来的一种试剂是( )
| A、H2SO4 |
| B、Ba(NO3)2 |
| C、Na2CO3 |
| D、AgNO3 |
 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )| A、该反应的化学方程式为3X+Y═2Z |
| B、2 min时,反应达最大限度,但化学反应仍在进行 |
| C、反应开始至2 min,Z的反应速率为0.10 mol?L-1?min-1 |
| D、反应达到平衡时,压强是开始时的0.9倍 |
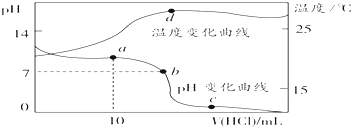 室温下,将1.00mol?L-1盐酸滴入20.00mL 1.00mol?L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
室温下,将1.00mol?L-1盐酸滴入20.00mL 1.00mol?L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )| A、a点溶液中离子浓度大小关系:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、b点溶液中离子浓度大小关系:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
| C、c点溶液中离子浓度大小关系:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| D、d点时溶液温度达到最高,之后温度略有下降,原因是NH3?H2O电离 |
最简式相同,但既不是同系物又不是同分异构体的是( )
A、CH≡CH和 |
| B、甲醚和甲醇 |
| C、环丙烷和环己烷 |
D、 |
 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析: