题目内容
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量).下列判断正确的是( )

| A、若T2>T1,达到平衡时b、d点的反应速率为vd>vb |
| B、若T2>T1,则正反应一定是放热反应 |
| C、达到平衡时A2的转化率大小为b>a>c |
| D、在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、温度越高,反应速率 越快,当T2>T1时,vd<vb;
B、由图可知,T2时AB3的体积分数大于T1时AB3的体积分数,当T2>T1时,则说明升高温度平衡正向移动,即正反应为吸热反应;
C、在可逆反应中增加一种反应物的浓度可以提高另一种物质的转化率,随着B2的量的增加,A2的转化率逐渐增大,即c>b>a;
D、在可逆反应中,随着B2的量的增加,A2的转化率逐渐增大,生成的AB3的物质的量逐渐增大.
B、由图可知,T2时AB3的体积分数大于T1时AB3的体积分数,当T2>T1时,则说明升高温度平衡正向移动,即正反应为吸热反应;
C、在可逆反应中增加一种反应物的浓度可以提高另一种物质的转化率,随着B2的量的增加,A2的转化率逐渐增大,即c>b>a;
D、在可逆反应中,随着B2的量的增加,A2的转化率逐渐增大,生成的AB3的物质的量逐渐增大.
解答:
解:A、温度越高,反应速率 越快,当T2>T1时,vd<vb,故A错误;
B、由图可知,T2时AB3的体积分数大于T1时AB3的体积分数,当T2>T1时,则说明升高温度平衡正向移动,即正反应为吸热反应,故B错误;
C、在可逆反应中增加一种反应物的浓度可以提高另一种物质的转化率,随着B2的量的增加,A2的转化率逐渐增大,即c>b>a,故C错误;
D、在可逆反应中,随着B2的量的增加,A2的转化率逐渐增大,生成的AB3的物质的量逐渐增大,故D正确;
故选D.
B、由图可知,T2时AB3的体积分数大于T1时AB3的体积分数,当T2>T1时,则说明升高温度平衡正向移动,即正反应为吸热反应,故B错误;
C、在可逆反应中增加一种反应物的浓度可以提高另一种物质的转化率,随着B2的量的增加,A2的转化率逐渐增大,即c>b>a,故C错误;
D、在可逆反应中,随着B2的量的增加,A2的转化率逐渐增大,生成的AB3的物质的量逐渐增大,故D正确;
故选D.
点评:本题主要考查影响化学平衡移动的因素以及影响化学反应速率的因素,中等难度,解题关键在于仔细审题,尤其是图象.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关某无色溶液中所含离子的检验,判断正确的是( )
| A、加入AgNO3溶液,生成白色沉淀,加入稀盐酸沉淀不溶解,可确定有Cl-存在 |
| B、加入稀盐酸,产生的气体能使澄清石灰水变浑浊,可确定有CO32-存在 |
| C、加入BaCl2溶液产生白色沉淀,再加入足量稀盐酸沉淀不溶解,确定有SO42-存在 |
| D、加入BaCl2溶液产生白色沉淀,加入稀硝酸沉淀溶解,并产生无色无味气体,且能使澄清石灰水变浑浊,确定含有CO32-离子 |
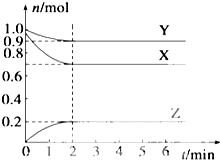 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )| A、该反应的化学方程式为3X+Y═2Z |
| B、2 min时,反应达最大限度,但化学反应仍在进行 |
| C、反应开始至2 min,Z的反应速率为0.10 mol?L-1?min-1 |
| D、反应达到平衡时,压强是开始时的0.9倍 |
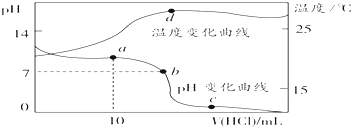 室温下,将1.00mol?L-1盐酸滴入20.00mL 1.00mol?L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )
室温下,将1.00mol?L-1盐酸滴入20.00mL 1.00mol?L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示.下列有关说法中不正确的是( )| A、a点溶液中离子浓度大小关系:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B、b点溶液中离子浓度大小关系:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
| C、c点溶液中离子浓度大小关系:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
| D、d点时溶液温度达到最高,之后温度略有下降,原因是NH3?H2O电离 |
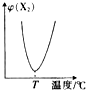 两种气体单质按以下化学方程式反应:X2(g)+Y2(g)?2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是( )
两种气体单质按以下化学方程式反应:X2(g)+Y2(g)?2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是( )| A、放热反应 |
| B、吸热反应 |
| C、可能是放热反应,也可能是吸热反应 |
| D、无法判断反应类型 |
最简式相同,但既不是同系物又不是同分异构体的是( )
A、CH≡CH和 |
| B、甲醚和甲醇 |
| C、环丙烷和环己烷 |
D、 |
相同体积的Na2SO4溶液(浓度为c1)和Al2(SO4)3溶液(浓度为c2),若其中SO42-的物质的量浓度相同,则c1和c2的关系是( )
| A、c1=c2 |
| B、c1=3 c2 |
| C、c2=3 c1 |
| D、无法确定 |