题目内容
在一定温度下,有a.醋酸 b.硫酸 c.盐酸三种酸:
(1)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是
用a、b、c表示,下同)
(2)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 ,反应所需时间的长短关系是 .
(3)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是 .
(1)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是
用a、b、c表示,下同)
(2)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为
(3)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是
考点:弱电解质在水溶液中的电离平衡,水的电离
专题:电离平衡与溶液的pH专题
分析:(1)酸或碱抑制水电离,酸中氢离子浓度或碱中氢氧根离子浓度越大,其抑制水电离程度越大;
(2)反应速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大;
反应速率越大,生成相同体积的氢气时,反应时间越短;
(3)HCl和硫酸是强电解质,在水溶液中完全电离,醋酸是弱酸,加水稀释促进醋酸电离.
(2)反应速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大;
反应速率越大,生成相同体积的氢气时,反应时间越短;
(3)HCl和硫酸是强电解质,在水溶液中完全电离,醋酸是弱酸,加水稀释促进醋酸电离.
解答:
解:(1)酸或碱抑制水电离,酸中氢离子浓度或碱中氢氧根离子浓度越大,其抑制水电离程度越大,当三种酸物质的量浓度相同时,三种酸中c(H+)大小顺序是b>a>c,所以抑制水电离程度大小顺序是b>a>c,则水电离程度大小顺序是a>c>b,故答案为:a>c>b;
(2)反应速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,三种酸中氢离子浓度相等,所以开始反应速率相等;
反应速率越大,生成相同体积的氢气时,反应时间越短,反应过程中,醋酸继续电离出氢离子,HCl和硫酸不再电离出氢离子,所以反应过程中c(H+)大小顺序是a>b=c,则反应速率大小顺序是a>b=c,所需时间长短顺序是b=c>a,
故答案为:a=b=c;b=c>a;
(3)HCl和硫酸是强电解质,在水溶液中完全电离,醋酸是弱酸,加水稀释促进醋酸电离,所以稀释相同倍数后,溶液中c(H+)由大到小的顺序是a>b=c,故答案为:a>b=c.
(2)反应速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,三种酸中氢离子浓度相等,所以开始反应速率相等;
反应速率越大,生成相同体积的氢气时,反应时间越短,反应过程中,醋酸继续电离出氢离子,HCl和硫酸不再电离出氢离子,所以反应过程中c(H+)大小顺序是a>b=c,则反应速率大小顺序是a>b=c,所需时间长短顺序是b=c>a,
故答案为:a=b=c;b=c>a;
(3)HCl和硫酸是强电解质,在水溶液中完全电离,醋酸是弱酸,加水稀释促进醋酸电离,所以稀释相同倍数后,溶液中c(H+)由大到小的顺序是a>b=c,故答案为:a>b=c.
点评:本题考查弱电解质电离,明确弱电解质电离特点即可解答,注意:反应速率与离子浓度有关,与电解质强弱无关.

练习册系列答案
相关题目
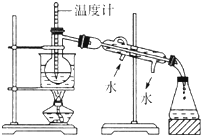 某化学课外小组以海带为原料制取少量碘水,现用CCl4 从碘水中萃取碘并用分液漏斗分离两种溶液.其实验可分解为如下各步:
某化学课外小组以海带为原料制取少量碘水,现用CCl4 从碘水中萃取碘并用分液漏斗分离两种溶液.其实验可分解为如下各步: