题目内容
18. 配合物[Cu(CH3C≡N)4]BF4是双烯合成反应的催化剂,它被浓硝酸分解的化学方程式为:[Cu(CH3C≡N)4]BF4$\stackrel{HNO_{3}}{→}$Cu2++H3BO3+CO2↑+HF…(未配平).
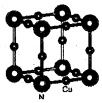
配合物[Cu(CH3C≡N)4]BF4是双烯合成反应的催化剂,它被浓硝酸分解的化学方程式为:[Cu(CH3C≡N)4]BF4$\stackrel{HNO_{3}}{→}$Cu2++H3BO3+CO2↑+HF…(未配平).(1)Cu2+基态核外电子排布式为1s22s22p63s23p63d9;铜与氮形成的一种化合物品胞结构如图所示,则该化合物的化学式为Cu3N.
(2)1mol H3BO3分子中含有氢键的数目为3mol.
(3)Na与CO2分子互为等电子体,N3-的结构式可表示为N2O(CO2、CS2等).
(4)配合物[Cu(CH3C≡N)4]BF4中:
①配体Cu(CH3C≡N分子中碳原子杂化轨道类型为sp、sp3杂化.
②[Cu(CH3C≡N)4]+的结构可用示意图表示为
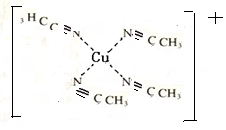 (不考虑空间构型).
(不考虑空间构型).
分析 (1)Cu原子核外电子排布为1s22s22p63s23p63d104s1,4s与3d能级各失去1个电子形成Cu2+;利用均摊法,根据晶胞中微粒个数的分配方法计算化学式;
(2)利用均摊法计算含1molH3BO3的晶体中的氢键;
(3)原子个数相等、价电子数相等的微粒互为等电子体;
(4)①根据价电子对互斥理论确定微粒的空间构型和原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数;
②氮原子提供电子,Cu提供空轨道,据此画出[Cu(CH3C≡N)4]+结构的示意图.
解答 解:(1)Cu原子核外电子排布为1s22s22p63s23p63d104s1,4s与3d能级各失去1个电子形成Cu2+,Cu2+基态核外电子排布式为1s22s22p63s23p63d9,根据晶胞中微粒个数的分配方法计算,晶胞中含有N原子的数目为8×$\frac{1}{8}$=1,Cu原子的数目为:12×$\frac{1}{4}$=3,故化学式为Cu3N,
故答案为:1s22s22p63s23p63d9;Cu3N;
(2)一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,因此含有1 molH3BO3分子的晶体中有3mol氢键,
故答案为:3;
(3)原子个数相等、价电子数相等的微粒互为等电子体,N3-中原子个数是3、价电子数是15,所以其等电子体有N2O、CO2、CS2,
故答案为:N2O(CO2、CS2等);
(4)①配体Cu(CH3C≡N分子中-CH3中C形成4个σ键,无孤电子对,中心C原子为sp3杂化,-C≡N中C形成2个σ键,无孤电子对,中心C原子为sp杂化,
故答案为:sp、sp3杂化;
②配位键是化学键的一种,两个或多个原子共同使用它们的外层电子,在理想情况下达到电子饱和的状态,氮原子提供电子,Cu提供空轨道,[Cu(CH3C≡N)4]+结构的示意图为: ,
,
故答案为: .
.
点评 本题考查原子核外电子排布、等电子体、晶胞计算、原子杂化轨道类型等,题目难度中等,注意掌握均摊法、价层电子对理论的熟练应用,为高频考点.

 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量=(填“>”“<”或“=”)890.3kJ.
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2,1g CH4完全反应可释放15.46kJ的热量,则:
①能表示该反应过程中能量变化的是(图1)D(填字母).

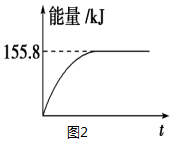
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图2所示,则CH4的转化率为63%.
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)═CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)═CH4(g)的反应热△H=-74.8kJ•mol-1.
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是C(填字母).
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
D.将固态碳合成为C60,以C60作为燃料
(5)工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2mol H2 | 1mol CH3OH | 2mol CO、4mol H2 |
| CH3OH的浓度(mol/L) | c1=0.25 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α1 | α2 | α3 |
A.v正(H2)=2v逆(CH3OH) B.n(CO)﹕n(H2)﹕n(CH3OH)=1﹕2:1
C.混合气体的密度不变 D.混合气体的平均相对分子质量不变 E.容器的压强不变
②下列说法正确的是AC.
A.c1=c2 B.Q1=Q2 C.K1=K2 D.α2+α3<100%
③如图表示该反应的反应速率v和时间t的关系图(图3):
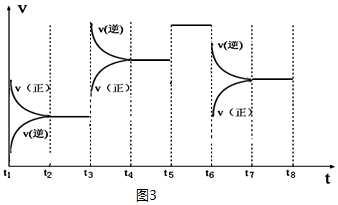
各阶段的平衡常数如表所示:
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K4 | K5 | K6 | K7 |
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b)-58.7 | I2-184.0 |
| ③ | (e)-19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O-100.0 | H2S-60.0 | (d)-42 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
| A. | a、b、c的化学式分别为Ne2、Br2、HF | |
| B. | 第②组物质均有氧化性;第③组物质对应水溶液均是强酸 | |
| C. | 第④组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te | |
| D. | 上表中同族物质对应的氢化物的沸点,均随相对分子质量的增大而升高 |
| A. | 30 g由14C2H2和C18O组成的混合气体中含有的质子数为14NA | |
| B. | 1 mol H2与1 mol I2 (g)混合后充分反应生成的HI分子数为2NA | |
| C. | 1 mol乙醇经催化氧化生成乙醛后转移的电子数为4NA | |
| D. | 25℃时,100 mL pH=2的新制氯水中:N(OH-)+N(ClO-)+N(HClO)=0.001NA |
| A. | H2和D2互为同位素 | |
| B. | 12C原子是指质子数为6,中子数是12的一种核素 | |
| C. | 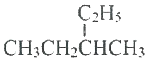 的名称是2-乙基丁烷 的名称是2-乙基丁烷 | |
| D. | 分子式为C2H6O、C4H10的有机物均有两种同分异构体 |
| A. | 不能与氧气反应 | B. | 储存巨大能量 | ||
| C. | 是氢的一种同素异形体 | D. | 内部存在自由移动的电子 |
| 实验方案 | 预测实验现象 | 相应结论 | |
| A | 向酸性Fe(NO3)3溶液通入少量H2S | 有黄色沉淀 | Fe(NO3)3中铁元素具有氧化性 |
| B | CH3CH2Br与NaOH乙醇共热后将气体通入酸性高锰酸钾溶液 | 高锰酸钾溶液褪色 | CH3CH2Br与NaOH乙醇溶液共热生成乙烯 |
| C | 测定相同条件下等物质的量浓度的CH3COONa、NaHCO3的pH | NaHCO3溶液的pH大 | 酸性:碳酸<乙酸 |
| D | 10mL0.1mol/L的NaOH溶液滴入2mL等浓度的MgCl2溶液,然后再滴加FeCl3溶液 | 先出现白色沉淀,后沉淀变为红褐色 | Ksp[Fe(OH)3]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
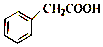 环扁桃酸酯是治疗心脑血管疾病的有效药物.苯乙酸是合成环扁桃酸酯的重要中间体,其结构简式如图,下列关于苯乙酸的说法错误的是( )
环扁桃酸酯是治疗心脑血管疾病的有效药物.苯乙酸是合成环扁桃酸酯的重要中间体,其结构简式如图,下列关于苯乙酸的说法错误的是( )| A. | 与苯甲酸互为同系物 | |
| B. | 有6种含酯基的芳香化合物与其互为同分异构体 | |
| C. | 能发生取代反应和加成反应 | |
| D. | 与CH3CH2OH所生成酯的分子式为C10H14O2 |
| 编号 | H2C2O4溶液 | 酸性KMnO溶液 | 温度℃ | ||
| 浓度/(mol•L-1) | 体积/mL | 浓度/(mol•L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
(2)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=0.010mol•L-1•min-1.