题目内容
SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用.其制备路线如图:
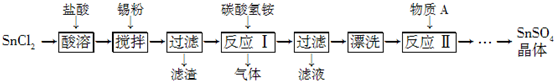
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+;SnCl2能水解生成碱式氯化亚锡[Sn(OH)Cl].
(1)写出物质A的名称: .
(2)SnCl2用盐酸而不用水溶解的原因是 (用化学方程式表示).
(3)锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式: .
(4)反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式: .该反应的温度需要控制在75℃左右的原因是 .
(5)实验室中“漂洗”沉淀的实验操作方法是 .

已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+;SnCl2能水解生成碱式氯化亚锡[Sn(OH)Cl].
(1)写出物质A的名称:
(2)SnCl2用盐酸而不用水溶解的原因是
(3)锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式:
(4)反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:
(5)实验室中“漂洗”沉淀的实验操作方法是
考点:制备实验方案的设计
专题:实验设计题
分析:SnCl2先用盐酸溶解,后又加了锡粉主要是防止在溶解时水解和被空气中氧气氧化,在过滤出锡粉,得到SnCl2溶液在反应Ⅰ与碳酸氢铵反应生成SnO、氯化铵、二氧化碳和水,再过滤得到SnO沉淀,经过漂洗除去表面的杂质离子,再在反应Ⅱ中与硫酸反应生成SnSO4,进一步提炼最终得到SnSO4晶体,据此分析;
(1)根据(4)反应Ⅰ生成的沉淀为SnO结合最终生成SnSO4来分析;
(2)SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解;
(3)酸性条件下,SnCl2可以被空气中的氧气氧化,将Sn2+氧化为Sn4+,自身被还原为水;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价没有变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳;碳酸氢铵受热易分解;
(5)(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次;
(1)根据(4)反应Ⅰ生成的沉淀为SnO结合最终生成SnSO4来分析;
(2)SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解;
(3)酸性条件下,SnCl2可以被空气中的氧气氧化,将Sn2+氧化为Sn4+,自身被还原为水;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价没有变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳;碳酸氢铵受热易分解;
(5)(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次;
解答:
解:SnCl2先用盐酸溶解,后又加了锡粉主要是防止在溶解时水解和被空气中氧气氧化,在过滤出锡粉,得到SnCl2溶液在反应Ⅰ与碳酸氢铵反应生成SnO、氯化铵、二氧化碳和水,再过滤得到SnO沉淀,经过漂洗除去表面的杂质离子,再在反应Ⅱ中与硫酸反应生成SnSO4,进一步提炼最终得到SnSO4晶体,据此分析;
(1)由(4)反应Ⅰ生成的沉淀为SnO,所以反应Ⅱ即SnO与A反应生成SnSO4,故A为硫酸,故答案为:硫酸;
(2)SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;故答案是:SnCl2+H2O?Sn(OH)Cl+HCl;
(3)酸性条件下,SnCl2可以被空气中的氧气氧化,将Sn2+氧化为Sn4+,自身被还原为水,离子方程式为:2Sn2++O2+4H+═2Sn4++2H2O,
故答案为:2Sn2++O2+4H+═2Sn4++2H2O;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价没有变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,化学方程式为:SnCl2+2NH4HCO3═SnO↓+2CO2↑+2NH4Cl+H2O,温度较低时反应速率小,温度较高时碳酸氢铵会分解,故答案为:SnCl2+2NH4HCO3═SnO↓+2CO2↑+2NH4Cl+H2O;温度较低时反应速率小,温度较高时碳酸氢铵会分解;
(5)“漂洗”的方法是:(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次;故答案为:(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次;
(1)由(4)反应Ⅰ生成的沉淀为SnO,所以反应Ⅱ即SnO与A反应生成SnSO4,故A为硫酸,故答案为:硫酸;
(2)SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;故答案是:SnCl2+H2O?Sn(OH)Cl+HCl;
(3)酸性条件下,SnCl2可以被空气中的氧气氧化,将Sn2+氧化为Sn4+,自身被还原为水,离子方程式为:2Sn2++O2+4H+═2Sn4++2H2O,
故答案为:2Sn2++O2+4H+═2Sn4++2H2O;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价没有变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,化学方程式为:SnCl2+2NH4HCO3═SnO↓+2CO2↑+2NH4Cl+H2O,温度较低时反应速率小,温度较高时碳酸氢铵会分解,故答案为:SnCl2+2NH4HCO3═SnO↓+2CO2↑+2NH4Cl+H2O;温度较低时反应速率小,温度较高时碳酸氢铵会分解;
(5)“漂洗”的方法是:(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次;故答案为:(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次;
点评:本题SnSO4制备的之比为载体,考查学生对工艺流程的理解、物质的分离提纯、阅读题目获取信息的能力、常用化学用语书写及利用关系式进行的计算等,难度中等,对学生的基础知识及逻辑推理有较高的要求.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
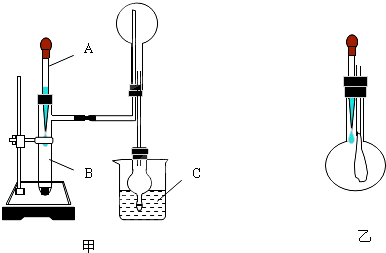
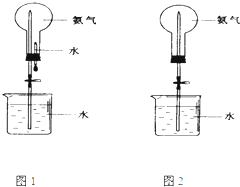 制取氨气并完成喷泉实验(图中夹持装置均已略去).
制取氨气并完成喷泉实验(图中夹持装置均已略去).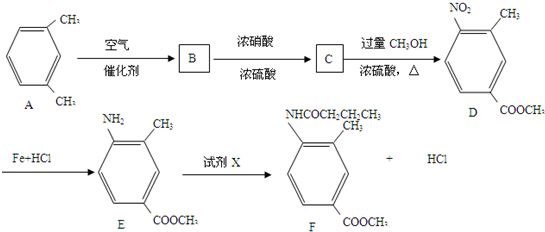
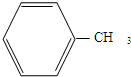 制备化合物
制备化合物