题目内容
10.汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液,常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=4.2×10-9.分析 常温下,测得某纯CaSO3与水形成的浊液pH为9,由可知CaSO3(s)?Ca2+(aq)+SO32-(aq),且SO32-+H2O?HSO3-+OH-,由Ka2(H2SO3)=6.0×10-9可知SO32-+H2O?HSO3-+OH-的水解Kh=$\frac{1{0}^{-14}}{6×1{0}^{-9}}$=1.67×10-4,以此计算c(SO32-),溶液中c(Ca2+)=c(SO32-)+c(HSO3-),结合Ksp(CaSO3)=c(Ca2+)×c(SO32-)计算.
解答 解:由Ka2(H2SO3)=6.0×10-9可知SO32-+H2O?HSO3-+OH-的水解Kh=$\frac{1{0}^{-14}}{6×1{0}^{-9}}$=1.67×10-4,
常温下,测得某纯CaSO3与水形成的浊液pH为9,c(HSO3-)=c(OH-)=1×10-5,
可知c(SO32-)=$\frac{(1×1{0}^{-5})^{2}}{1.67×1{0}^{-4}}$=6×10-5,
又c(Ca2+)=c(SO32-)+c(HSO3-)=7×10-5,
Ksp(CaSO3)=c(Ca2+)×c(SO32-)=7×10-5×6×10-5=4.2×10-9,
故答案为:4.2×10-9.
点评 本题综合考查难容电解质的溶解平衡以及弱电解质的电离,为高频考点,注意掌握盐的水解原理及其应用,试题培养了学生的分析能力及灵活应用能力,难度中等.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
5.根据下列物质的化学性质,判断其应用错误的是( )
| A. | 单质硅是将太阳能转化为电能的常用材料 | |
| B. | CaO能与SO2反应,可作工业废气的脱硫剂 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 | |
| D. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |
15.已知:常温下,Ksp(BaCO3)=2.5×10-9; Ksp(BaSO4)=1×10-10.现将0.5mol BaSO4放入1L 1.0mol•L-1 Na2CO3溶液中,反应一段时间达到平衡(不考虑溶液体积变化),下列说法不正确的是( )
| A. | Na2CO3溶液中:2c(H2CO3)+c(HCO3-)+c(H+)=c(OH-) | |
| B. | 该沉淀转化反应的平衡常数约为25 | |
| C. | 约有0.04 mol BaSO4溶解 | |
| D. | 反应后溶液中:c(Na+)>c (CO32-)>c(SO42-)>c(Ba2+) |
20.关于下列图示的说法中正确的是( )
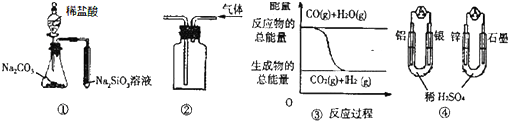

| A. | 用图 ①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图 ②所示实验装置排空气法收集CO2气体 | |
| C. | 图 ③表示反应 CO(g)+H2O(g)?CO2(g)+H2(g)是放热反应 | |
| D. | 图 ④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |