题目内容
19.Cl2、SO2和Na2O2都能使品红溶液褪色,下列有关说法正确的是( )| A. | Na2O2是碱性氧化物,SO2是酸性氧化物 | |
| B. | 分别加热用Cl2、SO2和Na2O2漂白过的品红溶液都能恢复红色 | |
| C. | 将Cl2和SO2同时通入水中能生成两种强电解质 | |
| D. | Cl2、SO2和Na2O2漂白原理相同 |
分析 A.过氧化钠与水反应生成氢氧化钠和氧气,不是碱性氧化物;
B.氯气以及过氧化钠漂白过的品红不能恢复;
C.将Cl2和SO2同时通入水中能生成盐酸和硫酸;
D.二氧化硫漂白性是和无色物质结合生成不稳定的无色物质,加热恢复原来的颜色.
解答 解:A.碱性氧化物与水反应只生成碱,而过氧化钠与水反应生成氢氧化钠和氧气,不是碱性氧化物,故A错误;
B.氯气以及过氧化钠都因具有强氧化性而漂白,漂白过的品红不能恢复,故B错误;
C.将Cl2和SO2同时通入水中能生成盐酸和硫酸,都为强电解质,故C正确;
D.二氧化硫漂白性是和无色物质结合生成不稳定的无色物质,加热恢复原来的颜色,氯气无漂白性,遇到水反应生成的次氯酸具有漂白性是次氯酸的强氧化性,过氧化钠具有强氧化性,故D错误.
故选C.
点评 本题考查较为综合,为高频考点,侧重于学生的分析能力的考查,题目涉及电解质与非电解质概念、氧化还原反应、氯气性质与过氧化钠结构等,是对基础知识的考查,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列实验中,只发生物理变化的是( )
| A. | 氨溶于水的喷泉实验 | |
| B. | 干冰暴露在干燥空气中,干冰周边气温降低 | |
| C. | 将分别蘸有浓氨水和浓盐酸的玻璃棒相互靠近,产生白烟 | |
| D. | 日光照射在装有新制氯水的烧瓶上,瓶中有气泡冒出 |
4.下列说法与盐的水解无关的是( )
| A. | 明矾可以作净水剂 | |
| B. | 配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度 | |
| C. | 加热稀氨水其溶液pH稍有变化 | |
| D. | 热的纯碱溶液可以去油污 |
7.取一定质量含Fe、FeO、Fe3O4的固体混合物,将其分成两等份,取其中一份用足量氢气还原,测得反应后的固体质量减少mg,另一份加入500mL4.0mol/L的稀硝酸,固体恰好完全溶解且同时收集到标准状况下NO气体4.48L,则m的值为( )
| A. | 6.4 | B. | 8 | C. | 3.2 | D. | 9.6 |
4.如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池.下列叙述正确的是( )
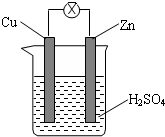

| A. | Zn是负极,发生还原反应 | |
| B. | 电子从锌片经外电路流向铜片 | |
| C. | 一段时间后溶液变蓝 | |
| D. | 铜片上可见气泡,一段时间后溶液总质量减少 |
5.某学生做如下实验:第一步,在淀粉KI溶液中滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失.下列对实验原理的解释和所得结论错误的是( )
| A. | 蓝色逐渐消失的原因是Na2SO3溶液具有漂白性 | |
| B. | 第一步反应的离子方程式ClO-+2I-+2H+═I2+Cl-+H2O | |
| C. | 淀粉KI溶液变蓝是因为I-被氧化为I2,I2使淀粉变蓝色 | |
| D. | 微粒的氧化性由强到弱的顺序是ClO->I2>SO${\;}_{4}^{2-}$ |
 .
.