题目内容
16.海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下: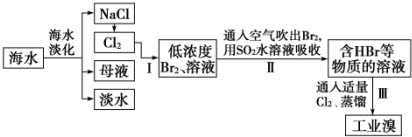
(1)请列举海水淡化的两种方法:蒸馏法、离子交换法.
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、Cl2、NaOH或H2、NaClO.
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br?,其目的为富集溴元素.
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,由此可知除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀.
分析 海水淡化得到氯化钠,电极氯化钠溶液或熔融状态氯化钠会生成氯气,氯气通入母液中发生反应得到低浓度的溴单质溶液,通入热空气吹出后用二氧化硫水溶液吸收得到韩HBr和的溶液,通入适量氯气氧化得到溴单质,富集溴元素,蒸馏得到工业溴,
(1)根据淡化海水的方法分析即可.
(2)将NaCl溶液进行电解,氯离子在阳极失电子发生氧化反应生成氯气,阴极上氢离子得到电子发生还原反应生成氢气,溶液中生成氢氧化钠,阳极产物和阴极产物能发生反应;
(3)海水淡化得到的母液和电解氯化钠溶液生成的氯气反应,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;
(4)根据反应Br2+SO2+2H2O═4H++SO42-+2Br-有强酸HBr和H2SO4生成,易腐蚀设备;
解答 解:(1)目前淡化海水的方法有多种,如:蒸馏法、离子交换法、反渗透法、电渗析法、水合物法、溶剂萃取法和冰冻法;
故答案为:蒸馏法、离子交换法;
(2)将NaCl溶液进行电解,氯离子在阳极失电子发生氧化反应生成氯气,阴极上氢离子得到电子发生还原反应生成氢气,溶液中生成氢氧化钠,其中氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以 在电解槽中可直接得到的产品有H2、Cl2、NaOH或H2、NaClO,
故答案为:Cl2、NaOH;NaClO;
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,
故答案为:富集溴元素;
(4)二氧化硫吸收溴单质发生反应:Br2+SO2+2H2O═4H++SO42-+2Br-,工业生产中应解决的主要问题是反应生成了两种强酸,易腐蚀设备,
故答案为:强酸对设备的严重腐蚀.
点评 本题考查了海水资源的综合利用,涉及到海水提溴工艺,烧碱工业流程,难度中等.

| A. | 6.4 | B. | 8 | C. | 3.2 | D. | 9.6 |
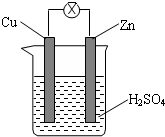
| A. | Zn是负极,发生还原反应 | |
| B. | 电子从锌片经外电路流向铜片 | |
| C. | 一段时间后溶液变蓝 | |
| D. | 铜片上可见气泡,一段时间后溶液总质量减少 |

| A. | 铜丝与盐酸不反应,可以用铜丝代替铂丝做焰色反应 | |
| B. | 用铂丝蘸取某溶液在酒精灯的火焰上灼烧时,火焰呈黄色,说明原溶液中是钠盐 | |
| C. | 某溶液在灼烧时透过蓝色钴玻璃看到火焰呈紫色,说明原溶液中含有K+ | |
| D. | 所有的金属及其化合物都有焰色反应 |
| A. | 过滤时将液体沿着玻璃棒注入过滤器,并使液面高于滤纸边缘 | |
| B. | 蒸馏时烧瓶需要垫石棉网 | |
| C. | 当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干 | |
| D. | 冷凝管的进水方向是低进高出 |
| A. | 蓝色逐渐消失的原因是Na2SO3溶液具有漂白性 | |
| B. | 第一步反应的离子方程式ClO-+2I-+2H+═I2+Cl-+H2O | |
| C. | 淀粉KI溶液变蓝是因为I-被氧化为I2,I2使淀粉变蓝色 | |
| D. | 微粒的氧化性由强到弱的顺序是ClO->I2>SO${\;}_{4}^{2-}$ |
| A. | Al3+、Cu2+、NO3- | B. | Na+、NO3-、Fe2+ | C. | Mg2+、NH4+、Cl- | D. | Ba2+、CO32-、Cl- |
 .
.

 、
、