题目内容
下列说法正确的是( )
| A、过量的铁在氯气中燃烧可生成氯化亚铁 |
| B、向Fe(NO3)2溶液加入盐酸,由于酸性增强抑制Fe2+的水解,使c(Fe2+)增大 |
| C、Fe和Fe2O3的混合物溶于盐酸中,再加入KSCN溶液,溶液一定变为血红色 |
| D、把一定量的铁和铜的混和粉未投入到FeCl3溶液中,不可能出现只有铁剩余没有铜剩余的情况 |
考点:铁的化学性质,氯气的化学性质,铁盐和亚铁盐的相互转变
专题:元素及其化合物
分析:A.氯气具有强氧化性;
B.在酸性条件下,Fe2+与NO3-发生氧化还原反应,3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
C.Fe和Fe2O3的混合物溶于盐酸中,当铁过量时,全部生成二价铁;
D.加入铁和铜的混合物,铁首先与氯化铁反应.
B.在酸性条件下,Fe2+与NO3-发生氧化还原反应,3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
C.Fe和Fe2O3的混合物溶于盐酸中,当铁过量时,全部生成二价铁;
D.加入铁和铜的混合物,铁首先与氯化铁反应.
解答:
解:A.氯气具有强氧化性,则过量的铁在氯气中燃烧可生成氯化铁,故A错误;
B.在酸性条件下,Fe2+与NO3-发生氧化还原反应,3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,Fe2+被氧化成三价铁离子,所以c(Fe2+)减小,故B错误;
C.Fe和Fe2O3的混合物溶于盐酸中,当铁过量时,全部生成二价铁,再加入KSCN溶液,溶液不变血红色,故C错误;
D.加入铁和铜的混合物,铁首先与氯化铁反应,可能铁全部反应而铜有剩余,不可能出现只有铁剩余没有铜剩余的情况,故D正确;
故选:D.
B.在酸性条件下,Fe2+与NO3-发生氧化还原反应,3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,Fe2+被氧化成三价铁离子,所以c(Fe2+)减小,故B错误;
C.Fe和Fe2O3的混合物溶于盐酸中,当铁过量时,全部生成二价铁,再加入KSCN溶液,溶液不变血红色,故C错误;
D.加入铁和铜的混合物,铁首先与氯化铁反应,可能铁全部反应而铜有剩余,不可能出现只有铁剩余没有铜剩余的情况,故D正确;
故选:D.
点评:本题考查铁及其化合物的性质,涉及氧化还原反应、三价铁离子的检验等,为常见的小综合习题,注重基础知识的考查,题目难度不大.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
在一定条件下某反应的热化学方程式为:2SO2(g)+O2(g)?2SO3(g);△H=-197kJ/mol
现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如表所示.根据以下数据,下列叙述正确的是( )
现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如表所示.根据以下数据,下列叙述正确的是( )
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
| A、Q2=98.5 kJ |
| B、2SO2(g)+O2(g)?2SO3(s);△H>-197KJ/mol |
| C、丙容器中压强大于乙,所以丙的反应速率大于乙 |
| D、2Q3<Q1<197KJ |
关于下列有机化合物的说法正确的是( )
| A、溴乙烷和乙烷都是饱和烃 |
| B、甲烷和乙烯都可以与氯气反应 |
| C、高锰酸钾可以氧化苯和甲烷 |
| D、乙烯可以与氢气发生加成反应,苯不能与氢气加成 |
对已经达到平衡的反应 2X(g)+Y(g)?2Z(g)△H<0,下列说法正确的是( )
| A、缩小容器体积,正、逆反应速率都增大,平衡向逆反应方向移动 |
| B、升高反应温度,该反应的平衡常数增大 |
| C、加入催化剂,可以降低反应所需的活化能,但不改变反应的△H |
| D、改变条件使平衡正向移动,反应物的转化率一定都增大 |
已知某温度下水的离子积KW=3.4×10-15.取该温度下浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
| A、0.01mol?L-1 |
| B、0.017mol?L-1 |
| C、0.05mol?L-1 |
| D、0.50mol?L-1 |
下列说法正确的是( )
| A、HR溶液的导电性较弱,HR属于弱酸 |
| B、某化合物溶于水导电,则该化合物为电解质 |
| C、根据电解质在其水溶液中能否完全电离,将电解质分为强电解质和弱电解质 |
| D、食盐是电解质,食盐的水溶液也是电解质 |
有关普通玻璃的叙述中,错误的是( )
| A、玻璃是混合物,主要成分是SiO2 及硅酸盐 |
| B、钢化玻璃与普通玻璃在组成成分差异很大 |
| C、玻璃不是晶体,称作玻璃态物质 |
| D、玻璃没有一定的熔点,在某温度范围内软化 |
用NA代表阿伏伽德罗常数,下列说法正确的是( )
| A、标准状况下,2.24LCHCl3的分子数0.1NA |
| B、1molNH3中含有3NA对电子对 |
| C、9.2gNO2和N2O4的混合气中含有的氮原子数为大于0.2NA |
| D、VL a mol?L-1的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA |
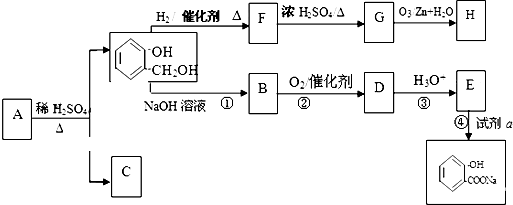
 与饱和溴水反应的化学方程式
与饱和溴水反应的化学方程式 反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论为
反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论为