题目内容
下列说法正确的是( )
| A、HR溶液的导电性较弱,HR属于弱酸 |
| B、某化合物溶于水导电,则该化合物为电解质 |
| C、根据电解质在其水溶液中能否完全电离,将电解质分为强电解质和弱电解质 |
| D、食盐是电解质,食盐的水溶液也是电解质 |
考点:电解质与非电解质,强电解质和弱电解质的概念
专题:
分析:A.电解质溶液导电能力与自由移动的离子浓度成正比;
B.电解质是指:该物质是化合物,溶于水溶液中或在熔融状态下就能够导电,是自身电离.酸、碱,在水溶液中和在熔融状态下两种情况下都不能导电的化合物称为非电解质;
C.强电解质和弱电解质的划分是看在水中是否能够完全电离;
D.电解质必须是化合物.
B.电解质是指:该物质是化合物,溶于水溶液中或在熔融状态下就能够导电,是自身电离.酸、碱,在水溶液中和在熔融状态下两种情况下都不能导电的化合物称为非电解质;
C.强电解质和弱电解质的划分是看在水中是否能够完全电离;
D.电解质必须是化合物.
解答:
解:A.电解质溶液导电能力与自由移动的离子浓度成正比,HR可能为强电解质,当电解质溶液的离子浓度较小时,溶液导电性较弱,故A错误;
B.溶于水能导电,不一定是自身电离,如二氧化碳在水溶液里,生成碳酸,碳酸能电离出自由移动的氢离子和碳酸根离子导电,不是二氧化碳自身电离,所以二氧化碳是非电解质,故B错误;
C.在水中能否完全电离可以将电解质分为强电解质和弱电解质,故C正确;
D.食盐水是混合物,既不是电解质也不是非电解质,故D错误;
故选C.
B.溶于水能导电,不一定是自身电离,如二氧化碳在水溶液里,生成碳酸,碳酸能电离出自由移动的氢离子和碳酸根离子导电,不是二氧化碳自身电离,所以二氧化碳是非电解质,故B错误;
C.在水中能否完全电离可以将电解质分为强电解质和弱电解质,故C正确;
D.食盐水是混合物,既不是电解质也不是非电解质,故D错误;
故选C.
点评:本题考查了强弱电解质的判断,电解质和非电解质的概念,注意电解质的强弱与其电离程度有关,与溶液的导电能力无关,为易错点.

练习册系列答案
相关题目
下列物质中,不能和氯气发生取代反应的是( )
| A、C8H18 |
| B、C2H5Cl |
| C、CH2Cl2 |
| D、CCl4 |
下列说法正确的是( )
| A、过量的铁在氯气中燃烧可生成氯化亚铁 |
| B、向Fe(NO3)2溶液加入盐酸,由于酸性增强抑制Fe2+的水解,使c(Fe2+)增大 |
| C、Fe和Fe2O3的混合物溶于盐酸中,再加入KSCN溶液,溶液一定变为血红色 |
| D、把一定量的铁和铜的混和粉未投入到FeCl3溶液中,不可能出现只有铁剩余没有铜剩余的情况 |
下列叙述中,正确的是( )
| A、熵变小于零而焓变大于零的反应肯定不能发生 |
| B、用蒸馏水稀释0.1mol/L的醋酸至0.01mol/L,稀释过程中温度维持25℃不变,溶液中各离子浓度均减小 |
| C、已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol |
| D、已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2;则△H1<△H2 |
为了应对能源危机,当今国际能源研究的热点是寻找新能源,下列不属于新能源的是( )
| A、氢能 | B、地热能 |
| C、风能 | D、天然气 |
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
| A、K+、MnO4-、Na+、Cl- |
| B、Na+、H+、NO3-、SO42- |
| C、Fe3+、Na+、Cl-、SO42- |
| D、K+、Na+、NO3-、CO32- |
下列有关反应的离子方程式书写不正确的是( )
| A、碳酸钙与盐酸反应:CO32-+2H+=CO2+H2O |
| B、硫酸钠溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| C、硝酸银溶液与盐酸反应:Ag++Cl-=AgCl↓ |
| D、氧化铜与稀硫酸反应:CuO+2H+═Cu2++H2O |
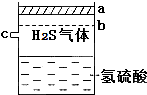 已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.
已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.