题目内容
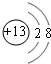
由①CaCO3、②KI、③Al(OH)3、④AgOH(Ag2O)、⑤I2五种物质所组成的混合物,要使其每种成分逐一溶解(一次只溶解一种物质),试剂选用顺序正确的是
- A.氨水乙醇水氢氧化钾硝酸
- B.四氯化碳水氨水氢氧化钠盐酸
- C.水苯氨水氢氧化钾硝酸
- D.水盐酸氢氧化钠氨水乙醇
B
碘易溶在有机溶剂中,因此首先用四氯化碳溶解碘;碳酸钙不溶于水,氢氧化银钠溶解在氨水中,而氢氧化铝不能,但氢氧化铝钠溶解在氢氧化钾中,所以正确的答案选B。
碘易溶在有机溶剂中,因此首先用四氯化碳溶解碘;碳酸钙不溶于水,氢氧化银钠溶解在氨水中,而氢氧化铝不能,但氢氧化铝钠溶解在氢氧化钾中,所以正确的答案选B。

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目


 H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 无土栽培是利用营养液栽培作物的一种方法.现有一种无色的营养液,可能由硝酸钙、碳酸钾、硝酸钾、氯化钾中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验.
无土栽培是利用营养液栽培作物的一种方法.现有一种无色的营养液,可能由硝酸钙、碳酸钾、硝酸钾、氯化钾中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验. (2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.
(2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.