题目内容
 (2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.
(2013?淄博一模)请运用化学反应原理的相关知识研究元素及其化合物的性质.(1)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)?CH3OH(g)△H1=-116KJ?mol-1
又知:CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则甲醇的燃烧热为
-739kJ?mol-1
-739kJ?mol-1
.(2)T℃时,向2L密闭容器中充入4mol CO和6mol H2,5min后达平衡时CH3OH物质的量为2mol.该反应的速率v(H2)为
0.4mol/(L?min)
0.4mol/(L?min)
;下列措施中有利于增大该反应的反应速率且提高转化率的是d
d
.a.随时将CH3OH与反应混合物分离
b.降低反应温度
c.使用高效催化剂
d.增大体系压强
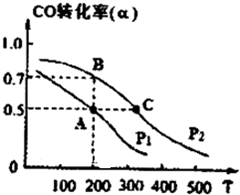
(3)在密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇,CO的转化率(a)与温度(T)、压强(P)的关系如图所示.
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tA
大于
大于
tc(填“大于”、“小于’’或“等于“).②若A点时容器的体积为10L,该温度下B点的平衡常数K=
1
1
.(4)Na2SO3的水溶液呈
碱
碱
(填“酸”、“中”、‘‘碱”)性,原因是(用离子方程式表示):SO32-+H2O?HSO3-+OH-
SO32-+H2O?HSO3-+OH-
;把CaCO3浊液滴入l.0mol/L的Na2SO3溶液中,能否产生CaSO3沉淀?若不能,说明原因;若可行,请简述判断依据及转化过程可行,判断依据是:由Ksp(CaSO3)/Ksp(CaCO3)=50知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变;转化过程为:把CaCO3浊液滴入0.1mol/L的Na2SO3溶液中时,溶液中的c(Ca2+)与c(SO32-)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3?Ca2++CO32-,向着溶解的方向移动,导致CaCO3溶解.
可行,判断依据是:由Ksp(CaSO3)/Ksp(CaCO3)=50知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变;转化过程为:把CaCO3浊液滴入0.1mol/L的Na2SO3溶液中时,溶液中的c(Ca2+)与c(SO32-)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3?Ca2++CO32-,向着溶解的方向移动,导致CaCO3溶解.
(已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9).
分析:(1)燃烧热是指可燃物完全燃烧生成稳定的氧化物所放出的热量,水为液态水,根据已知反应和目标反应,利用盖斯定律来计算反应热;
(2)根据速率公式计算出v(CH3OH),然后根据反应速率之比等于化学计量数之比计算氢气的反应速率;
根据外界条件(压强、温度、浓度以及使用催化剂)对化学反应速率的影响解答;
提高反应物的转化率,应使平衡向正反应方向移动,结合方程式的特点和影响化学平衡的条件(压强、温度、浓度)来解答;
(3)①根据温度对反应的影响来判断,温度越高,反应速率越大;
②根据图象判断出平衡时的各种物质的浓度,用平衡常数的表达式进行计算;
(4)Na2SO3为强碱弱酸盐,亚硫酸根离子水解使溶液显碱性;根据Ksp(CaSO3)/Ksp(CaCO3)=50可知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,溶液中的c(Ca2+)与c(SO32-)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3?Ca2++CO32-,向着溶解的方向移动,导致CaCO3溶解,即发生由CaCO3向CaSO3的转变.
(2)根据速率公式计算出v(CH3OH),然后根据反应速率之比等于化学计量数之比计算氢气的反应速率;
根据外界条件(压强、温度、浓度以及使用催化剂)对化学反应速率的影响解答;
提高反应物的转化率,应使平衡向正反应方向移动,结合方程式的特点和影响化学平衡的条件(压强、温度、浓度)来解答;
(3)①根据温度对反应的影响来判断,温度越高,反应速率越大;
②根据图象判断出平衡时的各种物质的浓度,用平衡常数的表达式进行计算;
(4)Na2SO3为强碱弱酸盐,亚硫酸根离子水解使溶液显碱性;根据Ksp(CaSO3)/Ksp(CaCO3)=50可知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,溶液中的c(Ca2+)与c(SO32-)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3?Ca2++CO32-,向着溶解的方向移动,导致CaCO3溶解,即发生由CaCO3向CaSO3的转变.
解答:解:(1)由①CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
②CO(g)+
O2(g)=CO2(g)△H2=-283kJ?mol-1
③H2(g)+
O2(g)=H2O (l)△H3=-286kJ?mol-1
根据盖斯定律可知,②+③×2-①可得 CH3OH(g)+
O2(g)=CO2(g)+2H2O (g)△H=(-283kJ?mol-1)+(-286kJ?mol-1)×2-(-116kJ?mol-1)=-739kJ?mol-1,
故答案为:-739kJ?mol-1;
(2)由图象可知v(CH3OH)=
=0.2mol/(L?min),根据反应速率之比等于化学计量数之比可知v(H2)=2v(CH3OH)=2×0.25mol/(L?min)=0.4mol/(L?min),
a.随时将CH3OH与反应混合物分离,提高了反应物的转化率,但没有增大该反应的反应速率,故a错误;
b.降低反应温度,平衡正向移动,提高了反应物的转化率,但减小了该反应的反应速率,故b错误;
c.使用高效催化剂,平衡不移动,反应物的转化率不变,但提高该反应的反应速率,故c错误;
d.增大体系压强,平衡正向移动,提高了反应物的转化率,同时提高了该反应的反应速率,故d正确;
故答案为:0.4 mol(L?min)-1;d;
(3)①升高温度,反应速率增大,反应开始到达平衡状态所需的时间要少,所以反应开始到达平衡状态所需的时间tA 大于tC,故答案为:大于;
②根据图象可以看出,A点时CO的转化率为50%,则平衡时各物质的量浓度为:c(CO)=0.5mol/L;c(H2)=1mol/L;c(CH3OH)=0.5mol/L,所以平衡常数为K=
=
=1;故答案为:1;
(4)Na2SO3为强碱弱酸盐,亚硫酸根离子水解使溶液显碱性,水解离子反应为:SO32-+H2O?HSO3-+OH-,可行,判断依据是:由Ksp(CaSO3)/Ksp(CaCO3)=50知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变;转化过程为:把CaCO3浊液滴入0.1mol/L的Na2SO3溶液中时,溶液中的c(Ca2+)与c(SO32-)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3?Ca2++CO32-,向着溶解的方向移动,导致CaCO3溶解.
故答案为:碱;SO32-+H2O?HSO3-+OH-;可行,判断依据是:由Ksp(CaSO3)/Ksp(CaCO3)=50知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变;转化过程为:把CaCO3浊液滴入0.1mol/L的Na2SO3溶液中时,溶液中的c(Ca2+)与c(SO32-)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3?Ca2++CO32-,向着溶解的方向移动,导致CaCO3溶解.
②CO(g)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
根据盖斯定律可知,②+③×2-①可得 CH3OH(g)+
| 3 |
| 2 |
故答案为:-739kJ?mol-1;
(2)由图象可知v(CH3OH)=
| ||
| 5min |
a.随时将CH3OH与反应混合物分离,提高了反应物的转化率,但没有增大该反应的反应速率,故a错误;
b.降低反应温度,平衡正向移动,提高了反应物的转化率,但减小了该反应的反应速率,故b错误;
c.使用高效催化剂,平衡不移动,反应物的转化率不变,但提高该反应的反应速率,故c错误;
d.增大体系压强,平衡正向移动,提高了反应物的转化率,同时提高了该反应的反应速率,故d正确;
故答案为:0.4 mol(L?min)-1;d;
(3)①升高温度,反应速率增大,反应开始到达平衡状态所需的时间要少,所以反应开始到达平衡状态所需的时间tA 大于tC,故答案为:大于;
②根据图象可以看出,A点时CO的转化率为50%,则平衡时各物质的量浓度为:c(CO)=0.5mol/L;c(H2)=1mol/L;c(CH3OH)=0.5mol/L,所以平衡常数为K=
| c(CH3OH) |
| c(CO)×c2(H2) |
| 0.5 |
| 12×0.5 |
(4)Na2SO3为强碱弱酸盐,亚硫酸根离子水解使溶液显碱性,水解离子反应为:SO32-+H2O?HSO3-+OH-,可行,判断依据是:由Ksp(CaSO3)/Ksp(CaCO3)=50知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变;转化过程为:把CaCO3浊液滴入0.1mol/L的Na2SO3溶液中时,溶液中的c(Ca2+)与c(SO32-)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3?Ca2++CO32-,向着溶解的方向移动,导致CaCO3溶解.
故答案为:碱;SO32-+H2O?HSO3-+OH-;可行,判断依据是:由Ksp(CaSO3)/Ksp(CaCO3)=50知,当CaSO3与CaCO3的混合液中c(SO32-)>50c(CO32-)时,即发生由CaCO3向CaSO3的转变;转化过程为:把CaCO3浊液滴入0.1mol/L的Na2SO3溶液中时,溶液中的c(Ca2+)与c(SO32-)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3?Ca2++CO32-,向着溶解的方向移动,导致CaCO3溶解.
点评:本题考查化学平衡的有关知识、盖斯定律以及盐类的水解,本题难度不大,做题时注意外界条件对化学反应速率和化学平衡的影响.

练习册系列答案
相关题目
 (2013?淄博一模)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
(2013?淄博一模)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
 -OOCCH3
-OOCCH3

