题目内容
(2011?南开区二模)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、M、R在周期表中的相对位置如表:J元素最低负化合价的绝对值与其原子最外层电子数相等.
请回答下列问题:
(1)M的离子结构示意图为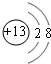
 ;元素R在周期表中位于第
;元素R在周期表中位于第
(2)J和氢组成的化合物分子有6个原子,其结构简式为
(3)M和T形成的化合物水溶液显
(4)L的最简单气态氢化物甲的水溶液显碱性.一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0并达到平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是
(5)将T的气态单质通入冷的消石灰中可制得漂白粉,写出漂白粉溶液在空气中失效的化学方程式为
(6)由J、R形成的液态化合物JR20.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为
| J | ||||
| M | R |
(1)M的离子结构示意图为


ⅥA
ⅥA
族.(2)J和氢组成的化合物分子有6个原子,其结构简式为
CH2=CH2
CH2=CH2
.(3)M和T形成的化合物水溶液显
酸
酸
性,用离子方程式解释原因Al3++2H2O?Al(OH)3+3H+
Al3++2H2O?Al(OH)3+3H+
.(4)L的最简单气态氢化物甲的水溶液显碱性.一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0并达到平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是
ad
ad
(选填序号).| 选项 | a | b | c | d |
| x | 温度 | 加入H2的物质的量 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO
2HCl+O2↑
| ||
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO
2HCl+O2↑
.
| ||
(6)由J、R形成的液态化合物JR20.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol
.分析:J、L、M、R、T是原子序数依次增大的短周期主族元素,由元素在周期表中的位置可知,J处于第二周期,M、R处于第三周期,J元素最低负化合价的绝对值与其原子最外层电子数相等,故J原子最外层电子数为4,故J为碳元素,则M为Al元素,R为硫元素,T的原子序数最大,故T为Cl元素,由(4)中L的最简单气态氢化物甲的水溶液显碱性,则L为氮元素,甲为NH3,据此解答.
解答:解:J、L、M、R、T是原子序数依次增大的短周期主族元素,由元素在周期表中的位置可知,J处于第二周期,M、R处于第三周期,J元素最低负化合价的绝对值与其原子最外层电子数相等,故J原子最外层电子数为4,故J为碳元素,则M为Al元素,R为硫元素,T的原子序数最大,故T为Cl元素,由(4)中L的最简单气态氢化物甲的水溶液显碱性,则L为氮元素,
(1)Al3+离子,质子数为13,核外电子数为10,有2个电子层,最外层电子数为8,离子结构示意图为 ,S元素在周期表中位于第ⅥA族,
,S元素在周期表中位于第ⅥA族,
故答案为: ;ⅥA;
;ⅥA;
(2)碳和氢组成的化合物分子有6个原子,该化合物为C2H4,其结构简式为CH2=CH2,故答案为:CH2=CH2;
(3)M和T形成的化合物为AlCl3,其水溶液中Al3+离子水解Al3++2H2O?Al(OH)3+3H+,破坏水的电离平衡,溶液呈酸性,
故答案为:酸;Al3++2H2O?Al(OH)3+3H+;
(4)L的最简单气态氢化物甲的水溶液显碱性,则L为氮元素,甲为NH3,发生分解反应:2NH3
N2+3H2,
a.该反应是吸热反应,温度升高,平衡向正反应移动,NH3的物质的量减小,故a符合;
b.化学平衡常数只受温度影响,温度不变,化学平衡常数不变,与氢气的用量无关,故b不符合;
c.加入H2的物质的量,氢气的浓度增大,平衡向逆反应进行,NH3的转化率降低,故c不符合;
d.加入甲的物质的量,平衡向正反应进行,总的物质的量增大,故d符合;
故答案为:ad;
(5)次氯酸钙与二氧化碳、水反应生成次氯酸,次氯酸分解,漂白粉溶液在空气中失效,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO
2HCl+O2↑,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO
2HCl+O2↑;
(6)液态化合物CS20.2mol在O2中完全燃烧,生成两种气态氧化物为CO2、SO2,298K时放出热量215kJ,故1molCS2完全燃烧放出的热量为215kJ×
=1075kJ,该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol,
故答案为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.
(1)Al3+离子,质子数为13,核外电子数为10,有2个电子层,最外层电子数为8,离子结构示意图为
 ,S元素在周期表中位于第ⅥA族,
,S元素在周期表中位于第ⅥA族,故答案为:
 ;ⅥA;
;ⅥA;(2)碳和氢组成的化合物分子有6个原子,该化合物为C2H4,其结构简式为CH2=CH2,故答案为:CH2=CH2;
(3)M和T形成的化合物为AlCl3,其水溶液中Al3+离子水解Al3++2H2O?Al(OH)3+3H+,破坏水的电离平衡,溶液呈酸性,
故答案为:酸;Al3++2H2O?Al(OH)3+3H+;
(4)L的最简单气态氢化物甲的水溶液显碱性,则L为氮元素,甲为NH3,发生分解反应:2NH3
| 一定条件 |
a.该反应是吸热反应,温度升高,平衡向正反应移动,NH3的物质的量减小,故a符合;
b.化学平衡常数只受温度影响,温度不变,化学平衡常数不变,与氢气的用量无关,故b不符合;
c.加入H2的物质的量,氢气的浓度增大,平衡向逆反应进行,NH3的转化率降低,故c不符合;
d.加入甲的物质的量,平衡向正反应进行,总的物质的量增大,故d符合;
故答案为:ad;
(5)次氯酸钙与二氧化碳、水反应生成次氯酸,次氯酸分解,漂白粉溶液在空气中失效,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO
| ||
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO
| ||
(6)液态化合物CS20.2mol在O2中完全燃烧,生成两种气态氧化物为CO2、SO2,298K时放出热量215kJ,故1molCS2完全燃烧放出的热量为215kJ×
| 1mol |
| 0.2mol |
故答案为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.
点评:本题考查元素周期表、常用化学用语、盐类水解、影响化学平衡的因素、热化学方程式书写等,题目较为综合,难度不大,注意对基础知识的全面理解掌握,推断元素是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 )的合成路线如下:
)的合成路线如下:


 )有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体共有
)有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体共有 (任意一种)
(任意一种)
