题目内容
16.设X、Y、Z代表3种元素.已知:①X+和Y-两种离子具有相同的电子层结构;
②Z元素原子核内质子数比Y原子核内质子数少9个;
③Y和Z两种元素可以形成4核42个电子的负一价阴离子.
据此,请填空:
(1)写出X、Y两种元素的名称X钾,Y氯.
(2)写出X、Y两种元素最高价氧化物对应水化物相互反应的离子方程式:OH-+H+═H2O.
分析 由Y和Z两种元素可以形成4核42个电子的负一价阴离子,分情况讨论、计算得Y、Z分别是氯、氧元素;结合①得是K元素.X、Y的最高价氧化物的水化物分别是氢氧化钾、高氯酸,它们发生的反应是酸碱中和反应生成盐和水.
解答 解:(1)Y和Z两种元素形成的4核负一价阴离子有以下三种情况:(1)Y2Z2-、(2)YZ3-、(3)Y3Z-,由于该负一价阴离子有42个电子,电子数是偶数,可排除情况(1),
根据情况(2)、(3)讨论、计算.令Z的质子数为n,由知②,则Y的质子数为n+9,若情况(2):(n+9)+3n+1=42;解之得:n=8;则n+9=17.所以Z为O元素,Y为Cl元素.
若情况(3):3(n+9)+n+1=42;解之得:n=3.5(不合题意,舍去).
故Z为O元素,Y为Cl元素.X+和Y-是两种简单的一价离子,具有相同的电子层结构,X、Y两元素处于相邻的两周期,且X位于Y的下一周期,Y为Cl,Cl-核外有18个电子,
所以X+核外有18个电子,因此,X+核内质子数为18+1=19,故X为K元素,
故答案为:钾;氯;
(2)K元素最高价氧化物对应水化物为KOH,是强碱;Cl元素最高价氧化物对应水化物HClO4,是强酸,两者相互反应的离子方程式为OH-+H+═H2O,
故答案为:OH-+H+═H2O.
点评 本题考查位置、结构与性质的关系,为高频考点,把握原子结构、电子排布知识推断元素为解答的关键,侧重分析与推断能力、应用能力的考查,题目难度不大.

练习册系列答案
相关题目
4.据报道,科学家已成功合成了少量的O4,有关O4的说法正确的是( )
| A. | O4的摩尔质量是64 g | |
| B. | O4与O2互为同位素 | |
| C. | O4与O3、O2都是氧元素的同分异构体 | |
| D. | 相同质量的O4与O3所含原子个数之比为1:1 |
11.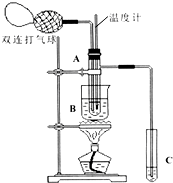 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
请回答下列问题:
(1)试管A内,60℃~80℃时发生的主要反应的化学方程式为2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处,目的是收集含乙酸的馏分;
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C;烧杯B内盛装的液体可以是乙二醇或甘油(在题给物质中确定).
 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
(1)试管A内,60℃~80℃时发生的主要反应的化学方程式为2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处,目的是收集含乙酸的馏分;
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C;烧杯B内盛装的液体可以是乙二醇或甘油(在题给物质中确定).
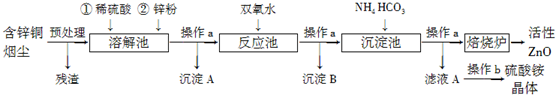
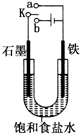 某课外活动小组同学用如图装置进行实验,试回答下列问题:
某课外活动小组同学用如图装置进行实验,试回答下列问题: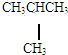
 和
和 E.葡萄糖和果糖F.(CH3)2CHCH3与C(CH3)4
E.葡萄糖和果糖F.(CH3)2CHCH3与C(CH3)4