题目内容
7.铜片和浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;(1)在该反应中,氧化剂与还原剂的物质的量之比为.浓硫酸体现的性质为:酸性和氧化性;该实验反应后溶液的蓝色往往不明显,试管中产物需用水稀释,具体操作为把实验反应后溶液放入烧杯,沿着烧杯壁加水,同时不断用玻璃棒搅拌:
(2)若在反应中生成了标况下2.24L二氧化硫,则反应中电子转移的数目1.204×1023.
分析 铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水;
(1)该反应中浓硫酸表现氧化性和酸性,还原剂Cu和氧化剂H2SO4的物质的量之比为1:1;实验后的溶液中含有浓硫酸,稀释过程与浓硫酸的稀释相似;
(2)n(Cu)=n(SO2),转移的电子的物质的量为2n(Cu).
解答 解:铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,反应的方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(1)产物CuSO4和SO2中的S都是来自硫酸,生成硫酸铜表现了浓硫酸的酸性,生成SO2表现了浓硫酸的氧化性,因此该反应中浓硫酸表现氧化性和酸性,还原剂Cu和氧化剂H2SO4的物质的量之比为1:1,实验后的溶液中含有浓硫酸,稀释过程与浓硫酸的稀释相似,具体操作为,把实验反应后溶液放入烧杯,沿着烧杯壁加水,同时不断用玻璃棒搅拌,
故答案为:1:1;酸性和氧化性;把实验反应后溶液放入烧杯,沿着烧杯壁加水,同时不断用玻璃棒搅拌;
(2)n(Cu)=n(SO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,Cu-2e-=Cu2+,因此转移电子的物质的量为2×0.1mol=0.2mol,数目为0.2mol×6.02×1023 mol-1=1.204×1023,
故答案为:1.204×1023.
点评 本题考查了浓硫酸的性质,为高频考点,涉及氧化还原原理、转移电子数的计算和实验操作,难度中等,掌握浓硫酸的性质和氧化还原反应原理是关键.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
17.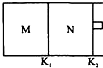 如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )
如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )
 如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )
如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )| A. | 反应达到平衡时N2的转化率:M<N | B. | H2的体积分数:M<N | ||
| C. | NH3的浓度:M<N | D. | 该反应在T℃时的平衡常数K:M=N |
18.某溶液中仅含Na+、H+、OH-、CH3COO-四种离子,下列说法错误的是( )
| A. | 溶液中四种粒子之间可能满足:c(Na+)>c(OH-)>c(H+)>c(CH3COO-) | |
| B. | 若溶液中部分粒子间满足:c(CH3COO-)=c(Na+),则该溶液一定呈中性 | |
| C. | 若溶液中溶质仅为CH3COONa,则粒子间一定满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间可能满足:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
15.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,22.4 L H2O所含的分子数为NA | |
| B. | 常温常压下,1 mol HD含有中子总数为2NA | |
| C. | 常温常压下,32 g O2中含有的分子数为NA | |
| D. | 100 mL 1 mol•L-1K2SO4溶液中含有的钾离子数为0.1 NA |
12.下列有关农业问题,所采取的措施或解释属于正确的是( )
| A. | 铵态氮肥和草木灰?含K2CO3能混合施用 | |
| B. | 化肥和农家肥?如绿肥?不可混合施用 | |
| C. | “盐碱地”中有Na2CO3通过加石膏使之生成碳酸钙,这样根据平衡移动原理,随着c(CO32-)浓度的降低,“盐碱地”的碱性降低 | |
| D. | 复合肥?如磷酸氢二铵?和生石灰能一起施用 |
19.(1)除去下列物质中所含少量杂质,填写所选用的试剂和分离方法
(2)某芳香族化合物的分子式为C7H8O,根据下列实验现象写出相应的结构简式:(要求:每小题只需给出一个答案即可.)
①不能与金属钠反应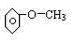 .
.
②能与钠反应,但遇FeCl3不显色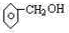 .
.
③能与钠反应且遇FeCl3显紫色 .
.
| 混合物 (括号内为少量杂质) | 试剂 (足量) | 分离方法 | |
| A | 苯(苯酚) | ||
| B | 乙酸乙酯(乙酸) | ||
| C | 乙醇(水) |
①不能与金属钠反应
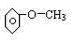 .
.②能与钠反应,但遇FeCl3不显色
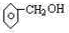 .
.③能与钠反应且遇FeCl3显紫色
 .
.
17.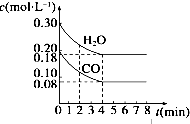 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g) CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g) CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
 800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g) CO和H2O(g)浓度变化如图所示.下列说法正确的是( )
800℃时在体积为1L恒容密闭容器中,通入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g)?H2(g)+CO2(g) CO和H2O(g)浓度变化如图所示.下列说法正确的是( )| A. | 容器中气体的压强不再改变则反应达到平衡 | |
| B. | 4 min后升高温度,CO和H2O(g)浓度也升高,则△H>0 | |
| C. | 800℃时只改变CO和H2O(g)起始投料,分别达平衡,CO的转化率与H2O(g)的转化率之和不变 | |
| D. | 若起始充入0.30 mol CO、0.10 mol H2O、0.20 mol CO2和20mol H2,则反应将向正反应方向进行 |
 .
.
 .
. .
.