题目内容
18.某课外活动小组设计了以下实验验证Ag与浓硝酸反应的过程中可能产生NO.其实验流程图如图1,2:
(1)测定硝酸的物质的量反应结束后,从如图3装置B中所得100mL溶液中取出25.00mL溶液,用0.1mol•L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示.在B容器中生成硝酸的物质的量为0.008 mol,则Ag与浓硝酸反应过程中生成的NO2在标准状况下的体积为268.8mL.
(2)测定NO的体积.
①从如图3所示的装置中,你认为应选用A装置进行Ag与浓硝酸反应实验,选用的理由是因为A装置可以通入N2将装置中的空气排尽,防止NO被空气中O2氧化.
②选用如图3所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是123547(填各导管口编号).
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置升高(填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平.
(3)气体成分分析.
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中有(填“有”或“没有”)NO产生,作此判断的依据是因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6<112.0).
分析 (1)B容器中是二氧化氮和水反应生成硝酸和一氧化氮;100mL溶液中取出25.00mL溶液,用0.1mol•L-1的NaOH溶液滴定,用酚酞作指示剂,终点时,消耗氢氧化钠溶液的体积为20.4ml-0.4ml=20ml;所以生成硝酸25.00mL溶液中含有0.02L×0.1mol/L=0.002mol,则B容器中生成硝酸的物质的量为0.008mol;由3NO2+H2O=2HNO3+NO可知金属反应生成二氧化氮物质的量为0.012mol,根据V=nVm计算NO2在标准状况下的体积;
(2)一氧化氮气体易被氧气氧化生成二氧化氮对验证产生干扰;选用图所示仪器组合一套可用来测定生成NO体积的装置,用水吸收生成的二氧化氮气体,可以用排水量气法测定一氧化氮气体的体积;依据量筒读取液体体积时需要和集气瓶液面相平,温度在常温下;
(3)若实验测得NO的体积为112.0mL(已折算到标准状况),结合二氧化氮反应生成的一氧化氮气体体积减小比较判断.
解答 解:(1)B容器中是二氧化氮和水反应生成硝酸和一氧化氮;100mL溶液中取出25.00mL溶液,用0.1mol•L-1的NaOH溶液滴定,用酚酞作指示剂,终点时,消耗氢氧化钠溶液的体积为20.4ml-0.4ml=20ml,所以生成硝酸25.00mL溶液中含有0.02L×0.1mol/L=0.002mol,则B容器中生成硝酸的物质的量为0.008mol,由3NO2+H2O=2HNO3+NO可知金属与硝酸反应生成二氧化氮物质的量为0.012mol,则Ag与浓硝酸反应过程中生成的NO2在标准状况下的体积V=nVm=0.012mol×22.4L/mol=268.8mL,
故答案为:0.008;268.8;
(2)①一氧化氮气体易被氧气氧化生成二氧化氮对验证产生干扰,AD相比A装置利用氮气可以把装置中的空气排净;
故答案为:A;因为A装置可以通入N2将装置中的空气排尽,防止NO被空气中O2氧化;
②用A进行铜和浓硝酸的反应,用水吸收生成的二氧化氮气体,导气管长进短出,可以用排水量气法测定一氧化氮气体的体积,排水集气瓶导气管应短进长出,连接顺序为:123547,
故答案为:123547;
③读数之前应保持内外压强相同,恢复到室温下读取量筒中液体的体积,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置升高,以保证量筒中的液面与集气瓶中的液面持平,
故答案为:升高;
(3)实验测得NO的体积为112.0mL(已折算到标准状况),依据上述计算得到Cu和浓硝酸生成二氧化氮气体物质的量为0.012mol,依据3NO2+H2O=2HNO3+NO可知一氧化氮气体物质的量为0.004mol,标准状况下体积为0.004×22.4L/mol=0.0896L=89.6ml<112.0L可知Cu和硝酸反应生成一氧化氮气体,
故答案为:有;因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6<112.0).
点评 本题考查性质实验方案的设计,为高频考点,把握物质的性质、实验装置的作用为解答的关键,侧重分析能力、实验能力及计算能力的综合考查,题目难度中等.

| A. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- | |
| B. | 在由水电离出的c(H+)=1×10-12mol/L的溶液:Fe3+、ClO-、Na+、SO42- | |
| C. | 加入金属铝产生H2的溶液中:Na+、K+、SO42-、Cl- | |
| D. | 饱和氯水中:Cl-、Na+、NO3-、SO32- |
| A. | Na+、NO3-、Al3+、K+ | B. | Na+、ClO3-、ClO-、ClO4- | ||
| C. | K+、Cr2O72-、I-、Na+ | D. | Na+、SO32-、SO42-、NH4+ |

| A. | 上述各物质中能发生水解反应的有A、B、D、G | |
| B. | 根据图示可推知D为苯酚 | |
| C. | A的结构中含有碳碳双键 | |
| D. | G的同分异构体中属于酯且能发生银镜反应的只有一种 |
| A. | 氯化铵与氢氧化钙混合加热:NH4++OH-=NH3↑+H2O | |
| B. | 铁片溶于足量稀硝酸:Fe+2H+=Fe2++H2↑ | |
| C. | 盐酸与AgNO3溶液反应:HCl+Ag+=H++AgCl↓ | |
| D. | 稀氨水与稀盐酸混合:NH3?H2O+H+=NH4++H2O |
| A. | 2.93 g | B. | 5.85 g | C. | 6.56g | D. | 无法确定 |
| 试管 | CaCO3的状态 | 盐酸的浓度 | 温度 |
| A | 块状 | 1mol•L-1 | 20℃ |
| B | 粉末状 | 1mol•L-1 | 20℃ |
| C | 块状 | 2mol•L-1 | 40℃ |
| D | 粉末状 | 2mol•L-1 | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
| A. | Cu和足量的稀硝酸反应产生4.48 L气体时,转移的电子数为0.6×6.02×1023 | |
| B. | 常温常压下,8.8 g CO2和N2O混合物中所含有的原子总数为0.6×6.02×1023 | |
| C. | 标准状况下,3.36 L己烷中含有的分子数目为0.15×6.02×1023 | |
| D. | 在1 L 0.2 mol/L的硫酸铁溶液中含有的三价铁离子数为0.4×6.02×1023 |
 (2)H2H:H(3)MgCl2
(2)H2H:H(3)MgCl2
 (5)CO2
(5)CO2 (6)Na2O
(6)Na2O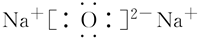
 ;O=C=O.
;O=C=O.