题目内容
9.在PH=1的溶液中,下列各组离子一定能存在的是( )| A. | Na+、NO3-、Al3+、K+ | B. | Na+、ClO3-、ClO-、ClO4- | ||
| C. | K+、Cr2O72-、I-、Na+ | D. | Na+、SO32-、SO42-、NH4+ |
分析 pH=1的溶液呈酸性,离子之间不反应生成气体、沉淀、弱电解质或发生氧化还原反应、络合反应、双水解反应且和氢离子不反应的能大量共存,以此解答该题.
解答 解:A.这几种离子之间不反应且和氢离子不反应,所以能大量共存,故A正确;
B.酸性条件下ClO-不能大量共存,故B错误;
C.酸性条件下Cr2O72-、I-发生氧化还原反应而不能大量共存,故C错误;
D.酸性条件下SO32-不能大量共存,故D错误.
故选A.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,侧重考查复分解反应,注意隐含条件的挖掘和利用,题目难度不大.

练习册系列答案
相关题目
19.水可以造福人类,但水被污染后会给人类造成巨大的灾难.为防止水体污染,下列措施不合理的是( )
| A. | 工业废水经处理达标后再排放 | B. | 农业生产中农药、化肥正确使用 | ||
| C. | 禁止使用化肥、农药 | D. | 城市垃圾妥善处理 |
20. 探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.
探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.
【提出问题】小松想探究分子的运动速率与相对分子质量的关系.
【假设猜想】①分子质量(相对分子质量)越大,分子运动速率越快;②分子质量(相对分子质量)越小,分子运动速率越快.
【查阅资料】已知浓氨水能挥发出氨气,浓盐酸能挥发出氯化氢气体,二者接触反应会产生白烟(即氯化铵固体).
【设计实验】如图所示,在玻璃管两端分别放入蘸有浓氨水和浓盐酸的棉花团.
【实验现象】C处产生的白烟较多.
【解释与结论】
(1)氨分子的相对分子质量小于(填“大于”、“等于”或“小于”)氯化氢分子的相对分子质量,由此可知,相对分子质量越小(填“大”或“小”),分子的速率越快(填“快”或“慢”).
(2)反应的化学方程式为NH3+HCl═NH4Cl.
【拓展探究】小松在完成上述实验后,还想研究分子运动速率与温度的关系.
他将等量的品红分别滴入到等量的热水和冷水中,其实验现象如下所示.
依据此实验现象,得出的结论是温度越高,分子的运动越快.
 探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.
探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.【提出问题】小松想探究分子的运动速率与相对分子质量的关系.
【假设猜想】①分子质量(相对分子质量)越大,分子运动速率越快;②分子质量(相对分子质量)越小,分子运动速率越快.
【查阅资料】已知浓氨水能挥发出氨气,浓盐酸能挥发出氯化氢气体,二者接触反应会产生白烟(即氯化铵固体).
【设计实验】如图所示,在玻璃管两端分别放入蘸有浓氨水和浓盐酸的棉花团.
【实验现象】C处产生的白烟较多.
【解释与结论】
(1)氨分子的相对分子质量小于(填“大于”、“等于”或“小于”)氯化氢分子的相对分子质量,由此可知,相对分子质量越小(填“大”或“小”),分子的速率越快(填“快”或“慢”).
(2)反应的化学方程式为NH3+HCl═NH4Cl.
【拓展探究】小松在完成上述实验后,还想研究分子运动速率与温度的关系.
他将等量的品红分别滴入到等量的热水和冷水中,其实验现象如下所示.
| 实验过程 | 冷水 | 热水 |
| 开始 | 红色扩散较慢 | 红色扩散较快 |
| 长久放置 | 最终均成为红色、均匀、透明的液体 | |
1.近日,我国不少城市出现了罕见的连续雾霾天气,导致当下雾霾天气的主要原因是化石燃料的大量使用,下列与治理雾霾天气的相关说法不正确的是( )
| A. | 推广燃煤脱硫技术,减少SO2污染,同时把煤粉碎了再燃烧以提高煤的燃烧效率 | |
| B. | 开发新能源,如太阳能、风能等,减少对化石能源的依赖 | |
| C. | 推广煤的气化、液化技术,提供清洁燃料和化工原料 | |
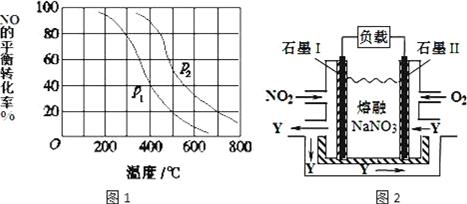
| D. | 在汽车尾气处理器中使用新的催化剂,促使平衡2CO+2NO?2CO2+N2向正反应方向移动,减少污染物的排放 |
 ,则 D 的核磁共振氢谱有6种峰.F 中的无氧官能团为碳碳双键.
,则 D 的核磁共振氢谱有6种峰.F 中的无氧官能团为碳碳双键.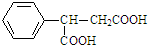 +CH3NH2$\stackrel{一定条件下}{→}$
+CH3NH2$\stackrel{一定条件下}{→}$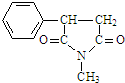 +2H2O.
+2H2O.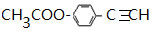 .
.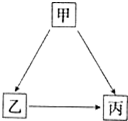 甲、乙、丙三种物质有如图所示的转化关系.
甲、乙、丙三种物质有如图所示的转化关系.
