题目内容
4.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )| A. | 氯水的颜色呈浅绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
分析 溶液中存在平衡Cl2+H2O?HCl+HClO,只有氯气有颜色,为黄绿色,氯水中含有氯气而呈浅黄绿色,溶液中HCl与硝酸银反应产生AgCl白色沉淀,而溶液呈酸性,能与碳酸氢钠反应生成二氧化碳,溶液中氯气、HClO都强氧化性,都可以将亚铁离子氧化为铁离子,而使溶液变为棕黄色.
解答 解:溶液中存在平衡Cl2+H2O?HCl+HClO,
A.只有氯气有颜色,为黄绿色,氯水呈浅黄绿色是由于含有氯气,故A正确;
B.溶液与硝酸银反应产生白色沉淀,只能是氯离子与银离子反应得到AgCl白色沉淀,说明氯水中含有Cl-,故B正确;
C.溶液呈酸性,能与碳酸氢钠反应生成二氧化碳,故C正确;
D.溶液中氯气、HClO都强氧化性,都可以将亚铁离子氧化为铁离子,而使溶液变为棕黄色,不能说明氯水中含有HClO,故D错误,
故选D.
点评 本题考查氯水的性质,难度不大,侧重对基础知识的考查,需要学生熟练掌握基础知识.

练习册系列答案
相关题目
15.如图装置应用于实验室制氯气和有关氯气性质的实验,能达到实验目的是( )

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 装置丙:生成棕色的固体,证明Cl2有强氧化性 | |
| D. | 装置丁:湿润的有色布条褪色,证明Cl2有漂白性 |
19.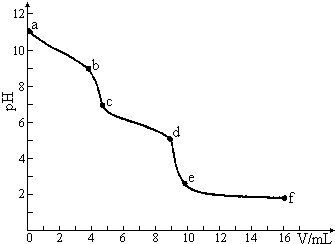 常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )
常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )
 常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )
常温下,用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如下图(已知:饱和CO2溶液的pH为5.6),下列说法正确的是 ( )| A. | 该Na2CO3溶液的浓度为0.001mol/L | |
| B. | 在pH=7时,c(Na+)=c(Cl-) | |
| C. | 在pH=6时,c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | c→d发生的主要离子反应为:CO32-+H+=HCO3- |
9.下列说法正确的是( )
| A. | 对于有气体参加的反应,增大压强,反应速率加快,是因为活化分子百分数增加 | |
| B. | 设NA为阿伏加德罗常数的值,500 mL 1mol/L氯化铁溶液中Fe3+的数目等于0.5NA | |
| C. | 常温下将干燥的pH试纸浸泡在0.01mol/L的NaOH溶液中来测溶液的pH,测得pH=12 | |
| D. | 要判断反应进行方向,须综合考虑体系的焓变和熵变,焓减且熵增的反应为自发反应 |
16.已知 25℃时有关弱酸的电离平衡常数如下:
下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 1mol/L醋酸溶液加水稀释后,所有离子浓度均减小 | |
| B. | Na2CO3溶液中,一定有2c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | |
| C. | 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) | |
| D. | 1 mol•L-1HCN溶液与1mol•L-1NaOH溶液等体积混合后,测得所得溶液显酸性 |