题目内容
15.如图装置应用于实验室制氯气和有关氯气性质的实验,能达到实验目的是( )
| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 装置丙:生成棕色的固体,证明Cl2有强氧化性 | |
| D. | 装置丁:湿润的有色布条褪色,证明Cl2有漂白性 |
分析 A.依据浓盐酸与二氧化锰反应条件判断;
B.氯化氢、氯气能够与碳酸氢钠反应;
C.氯气与铜反应生成氯化铜,依据反应中氯元素化合价变化判断氯气性质;
D.干燥的有色布条不褪色,证明Cl2无漂白性;
解答 解:A.浓盐酸与二氧化锰反应需要加热,故A错误;
B.氯化氢、氯气能够与碳酸氢钠反应生成二氧化碳,吸收部分氯气同时引入杂质二氧化碳新杂质,故B错误;
C.氯气与铜反应生成氯化铜,氯元素化合价降低,表现氯气的强的氧化性,故C正确;
D.干燥的有色布条不褪色,湿润的有色布条褪色,证明Cl2无漂白性,有漂白性的是次氯酸,故D错误;
故选:C.
点评 本题考查了氯气的实验室制法和氯气的性质,题目难度不大,明确氯气的制备原理和性质是解题关键.

练习册系列答案
相关题目
6.已知丙烷的燃烧热△H=-2215kJ•mol-1,若一定量的丙烷完全燃烧后生成1.8g液态水,则放出的热量约为( )
| A. | 55 kJ | B. | 220 kJ | C. | 550 kJ | D. | 1 108 kJ |
3.比较是化学学习中的一种重要方法.下列各组比较中错误的是( )
| A. | 在相同温度下的溶解度:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3>H2CO3 | |
| C. | 表示Na2CO3和NaHCO3分别与Ba(OH)2溶液反应的离子方程式相同 | |
| D. | 等质量的Na2CO3和NaHCO3分别与等浓度的HCl溶液完全反应,后者消耗的盐酸少 |
10.下列说法正确的是( )
| A. | HD、CaCl2、NaOH、HCl四种物质都属于化合物 | |
| B. | 有单质参加或生成的反应一定属于氧化还原反应 | |
| C. | 金属氧化物不一定是碱性氧化物,非金属氧化物不一定是酸性氧化物 | |
| D. | 金属单质只能做还原剂,非金属单质只能做氧化剂 |
20.如果家里的食用菜籽油混有少量水份,你将采用下列何种方法分离( )
| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 结晶 |
7.下列溶液中c(Cl-)与150mL 1mol/L NaCl溶液中c(Cl-)相等的是( )
| A. | 50mL 3mol/L KCl溶液 | B. | 75 mL 2mol/L CaCl2溶液 | ||
| C. | 100 mL 0.5mol/L BaCl2溶液 | D. | 50mL 1mol/L AlCl3溶液 |
4.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 氯水的颜色呈浅绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
5.工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
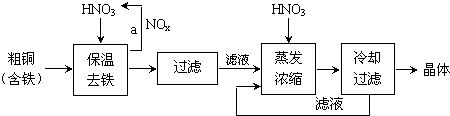
①在步骤a中,还需要通入氧气和水,其目的是提高原料的利用率,减少污染物的排放.
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在3.2~4.7 范围.

①在步骤a中,还需要通入氧气和水,其目的是提高原料的利用率,减少污染物的排放.
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在3.2~4.7 范围.
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |