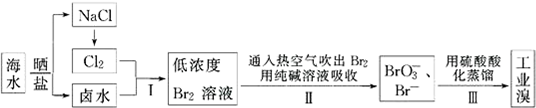
题目内容
12.若要使0.5mol 甲烷和Cl2发生取代反应,反应后CH4与Cl2均无剩余,并生成相同物质的量的四种取代物,则需要Cl2的物质的量为( )| A. | 2.5 mol | B. | 2 mol | C. | 1.25 mol | D. | 0.5 mol |
分析 根据碳原子守恒计算四种有机物的物质的量,根据关系式Cl2~CH3Cl、2Cl2~CH2Cl2、3Cl2~CHCl3、4Cl2~CCl4,计算总共消耗的氯气的物质的量.
解答 解:反应完全后,得四种有机物物质的量相等,根据碳原子守恒知,CH3Cl、CH2Cl2、CHCl3、CCl4的物质的量都是0.125mol,CH4与Cl2发生取代反应:1个氯原子替换出1个氢原子,另一个氯原子则与氢原子结合生成HCl,可得关系式:Cl2~CH3Cl,2Cl2~CH2Cl2,3Cl2~CHCl3,4Cl2~CCl4,
生成0.125molCH3Cl需要Cl2的物质的量为0.125mol,
生成0.125molCH2Cl2需要Cl2的物质的量为0.125mol×2=0.25mol,
生成0.125molCHCl3需要Cl2的物质的量为0.125mol×3=0.375mol,
生成0.125molCCl4需要Cl2的物质的量为0.125mol×4=0.5mol,
所以总共消耗的氯气的物质的量n(Cl2)=(0.125+0.25+0.375+0.5)mol=1.25mol,
故选:C.
点评 本题考查化学方程式计算、取代反应,注意把握氯气与甲烷发生取代反应的特征,明确取代反应中被取代的氢原子的物质的量与氯气分子的物质的量的关系是解本题的关键.

练习册系列答案
相关题目
13.下列烷烃在光照条件下与氯气发生反应,可以生成4种一氯代物的是( )
| A. | CH3CH2CH2CH3 | B. | CH3CH(CH3)2 | C. | CH3C(CH3)3 | D. | (CH3)2CHCH2CH3 |
3.下列关于反应热的说法正确的是( )
| A. | 当△H为负值时,表示该反应为吸热反应 | |
| B. | 反应热的大小只与反应体系的始态和终态有关 | |
| C. | 反应热的大小与反应物所具有的能量和生成物具有的能量无关 | |
| D. | 热化学方程式2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,表示2 L氢气和1 L氧气反应放出571.6 kJ的热量 |
20.下列各对物质,相互间不属于同系物的是( )
| A. | CH3-CH═CH2与C2H4 | B. | CH3COOCH3与CH3CH2COOCH3 | ||
| C. | 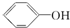 与 与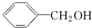 | D. | CH3CH2Cl与CH3CHClCH3 |
17.构成下列四种物质的微粒间,既存在离子键又存在共价键的是( )
| A. | CH3CH2ONa | B. | K2S | C. | MgCl2 | D. | SO3 |
1.表为元素周期表的一部分,用化学符号回答下列问题.
(1)元素②的单质的结构式N≡N 元素⑧的+1价含氧酸的结构式H-O-Cl.
(2)元素①的最高价氧化物的电子式 ,元素③和⑤形成原子个数比为1:1的化合物的电子式
,元素③和⑤形成原子个数比为1:1的化合物的电子式 ,元素②、④的气态氢化物反应后的产物的电子式
,元素②、④的气态氢化物反应后的产物的电子式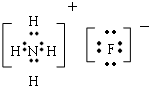 .
.
(3)用电子式表示元素④和⑨形成化合物的过程 .
.
(4)元素③、④、⑥、⑦对应的气态氢化物中,稳定性最弱的是PH3(填化学式)
(5)元素④、⑤、⑦、⑨形成的简单离子中,半径最大的离子的离子结构示意图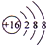 ;
;
(6)元素⑥、⑦、⑩对应的最高价氧化物的水化物中,酸性最强的是H2SO4(填化学式),250mL 1mol/L的该溶液与足量的稀氨水反应放出的热量为Q1kJ,该反应的热化学方程式为:H2SO4(aq)+2NH3•H2O(aq)=(NH4)2SO4(aq)+2H2O(l)△H=-4Q1kJ/mol,元素⑤、⑧的最高价氧化物的水化物的稀溶液反应生成1mol水时放出Q2kJ的热量,则NH3•H2O(aq)?NH4+(aq)+OH-(aq)△H=(Q2-2Q1)kJ/mol.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 第二周期 | ① | ② | ③ | ④ | |||
| 第三周期 | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 第四周期 | ⑨ | ⑩ |
(2)元素①的最高价氧化物的电子式
 ,元素③和⑤形成原子个数比为1:1的化合物的电子式
,元素③和⑤形成原子个数比为1:1的化合物的电子式 ,元素②、④的气态氢化物反应后的产物的电子式
,元素②、④的气态氢化物反应后的产物的电子式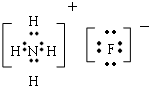 .
.(3)用电子式表示元素④和⑨形成化合物的过程
 .
.(4)元素③、④、⑥、⑦对应的气态氢化物中,稳定性最弱的是PH3(填化学式)
(5)元素④、⑤、⑦、⑨形成的简单离子中,半径最大的离子的离子结构示意图
 ;
;(6)元素⑥、⑦、⑩对应的最高价氧化物的水化物中,酸性最强的是H2SO4(填化学式),250mL 1mol/L的该溶液与足量的稀氨水反应放出的热量为Q1kJ,该反应的热化学方程式为:H2SO4(aq)+2NH3•H2O(aq)=(NH4)2SO4(aq)+2H2O(l)△H=-4Q1kJ/mol,元素⑤、⑧的最高价氧化物的水化物的稀溶液反应生成1mol水时放出Q2kJ的热量,则NH3•H2O(aq)?NH4+(aq)+OH-(aq)△H=(Q2-2Q1)kJ/mol.
2.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol乙基中含有的电子数为16NA | |
| B. | 8g CH4中含有10NA个电子 | |
| C. | 标准状况下22.4L氯仿中共价键数目为4NA | |
| D. | 28g乙烯、丙烯、丁烯的混合气体,其碳原子数为2NA |
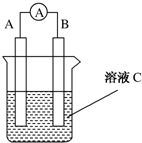 如图所示是原电池的装置图(
如图所示是原电池的装置图( 为电流表).请回答:
为电流表).请回答: