题目内容
5.下列关于氧化还原反应的说法错误的是( )| A. | KClO3+6HCl═3Cl2↑+KCl+3H2O反应中还原剂与氧化剂的物质的量之比为6:1 | |
| B. | 硝酸铵受热分解的化学方程式为:5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子数之比为5:3 | |
| C. | 工业上制备新型净水剂高铁酸钾(K2FeO4)的一步反应如下:2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O,若有2 mol FeCl3发生反应,转移电子的物质的量为6 mol | |
| D. | 氮化铝广泛应用于电子陶瓷等工业领域.在一定条件下,AlN可通过反应:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO合成,方程式中AlN中氮的化合价为-3 |
分析 A.该反应氯酸钾中Cl元素化合价由+5价变为0价、参加反应的$\frac{5}{6}$HCl中Cl元素化合价由-1价变为0价;
B.该反应中铵根离子中N元素化合价由-3价变为0价,硝酸根离子中有$\frac{3}{5}$的N元素化合价由+5价变为0价;
C.该反应中Fe元素化合价由+3价变为+6价,NaClO中Cl元素化合价由+1价变为-1价;
D.AlN中Al元素化合价为+3价.
解答 解:A.该反应氯酸钾中Cl元素化合价由+5价变为0价、参加反应的$\frac{5}{6}$HCl中Cl元素化合价由-1价变为0价,氯酸钾是氧化剂、$\frac{5}{6}$HCl是还原剂,则还原剂和氧化剂的物质的量之比为5:1,故A错误;
B.该反应中铵根离子中N元素化合价由-3价变为0价,硝酸根离子中有$\frac{3}{5}$的N元素化合价由+5价变为0价,铵根离子被氧化、$\frac{3}{5}$的硝酸根离子被还原,则被氧化与被还原的氮原子数之比为5:3,故B正确;
C.该反应中Fe元素化合价由+3价变为+6价,NaClO中Cl元素化合价由+1价变为-1价,若有2 mol FeCl3发生反应,转移电子的物质的量=2mol×(6-3)=6 mol,故C正确;
D.AlN中Al元素化合价为+3价,根据化合物中各元素化合价代数和为0知,N元素化合价为-3价,故D正确;
故选A.
点评 本题考查氧化还原反应,为高频考点,侧重考查学生分析判断及计算能力,明确元素化合价变化及基本概念是解本题关键,注意A中并不是所有的HCl都作还原剂,为易错点.

练习册系列答案
相关题目
19.25℃时,向25mL 0.1mol•L-1H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )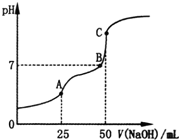

| A. | HC2O4-的电离程度大于其水解程度 | |
| B. | B点时溶液中含有Na2HC2O4和Na2C2O4 | |
| C. | C点时,c(Na+)>c(C2O42-)>c(HC2O4- )>c(OH-)>c(H+) | |
| D. | A点时,c(Na+)+c(H+)═c(OH-)+c(HC2O4-)+2c(C2O42-) |
10.关于电化学的下列说法正确的是( )


| A. | 工业上用电解MgCl2溶液的方法冶炼Mg | |
| B. | 钢铁发生吸氧腐蚀的正极反应式为4OH--4e-═O2↑+2H2O | |
| C. | 如图中发生反应的方程式为:Fe+2H+=Fe2++H2↑ | |
| D. | 碱性锌锰干电池放电时的正极反应为:MnO2+H2O+e-=MnOOH+OH- |
17.下列元素非金属性最强的是( )
| A. | Cl | B. | F | C. | N | D. | O |
14.氢氧化镁用于制药工业,还是重要的绿色阻燃剂.
Ⅰ.治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2.
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子式方程式为Mg(OH)2+2H+=Mg2++2H2O;
Ⅱ.已知:
H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H1=+242kJ•mol-1
Mg(s)+2H2O(g)=Mg(OH)2(s)+H2(g)△H2=-441kJ•mol-1
Mg(s)+$\frac{1}{2}$O2(g)=MgO(s)△H3=-602kJ•mol-1
(2)氢氧化镁分解的热化学方程式为Mg(OH)2(s)=MgO(s)+H2O(g);△H=81KJ/mol;
Ⅲ.某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制.获得阻燃剂氢氧化镁.
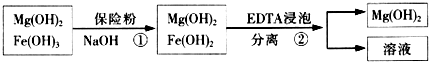
(3)步骤①中加入保险粉(Na2S2O4)的作用:将氢氧化铁还原为氢氧化亚铁.
(4)已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(OH)2反应.虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2.请从沉淀溶解平衡的角度加以解释Fe(OH)2悬浊液中存在如下平衡:Fe(OH)2(s)=Fe2+(aq)+2OH-(aq)当不断滴入EDTA时,EDTA将结合Fe 2+促使平衡向右移动而使Fe(OH)2不断溶解;
Ⅳ.为研究不同分离提纯条件下所制得阻燃剂的纯度从而确定最佳提纯条件,某研究小组各取等质量的下列4组条件下制得的阻燃剂进行含铁量的测定,结果如下:
(5)若不考虑其它条件,根据上表数据,制取高纯度阻燃剂最佳条件是C(填字母).
①40℃②60℃③EDTA质量为0.05g④EDTA质量为0.10g ⑤保险粉质量为0.05g ⑥保险粉质量为0.10g
A.①③⑤B.②④⑥C.①④⑥D.②③⑤
Ⅰ.治疗胃酸过多药物Stmoache的有效成分为Mg(OH)2.
(1)该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子式方程式为Mg(OH)2+2H+=Mg2++2H2O;
Ⅱ.已知:
H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H1=+242kJ•mol-1
Mg(s)+2H2O(g)=Mg(OH)2(s)+H2(g)△H2=-441kJ•mol-1
Mg(s)+$\frac{1}{2}$O2(g)=MgO(s)△H3=-602kJ•mol-1
(2)氢氧化镁分解的热化学方程式为Mg(OH)2(s)=MgO(s)+H2O(g);△H=81KJ/mol;
Ⅲ.某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制.获得阻燃剂氢氧化镁.
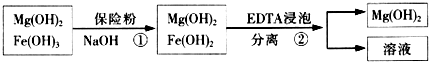
(3)步骤①中加入保险粉(Na2S2O4)的作用:将氢氧化铁还原为氢氧化亚铁.
(4)已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(OH)2反应.虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2.请从沉淀溶解平衡的角度加以解释Fe(OH)2悬浊液中存在如下平衡:Fe(OH)2(s)=Fe2+(aq)+2OH-(aq)当不断滴入EDTA时,EDTA将结合Fe 2+促使平衡向右移动而使Fe(OH)2不断溶解;
Ⅳ.为研究不同分离提纯条件下所制得阻燃剂的纯度从而确定最佳提纯条件,某研究小组各取等质量的下列4组条件下制得的阻燃剂进行含铁量的测定,结果如下:
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
①40℃②60℃③EDTA质量为0.05g④EDTA质量为0.10g ⑤保险粉质量为0.05g ⑥保险粉质量为0.10g
A.①③⑤B.②④⑥C.①④⑥D.②③⑤
15.雾霾严重影响人们的生活与健康.某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-.某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
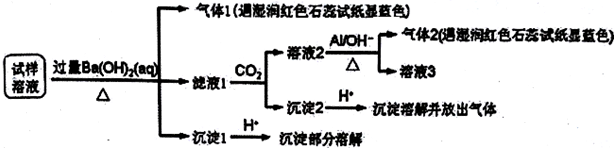
己知:3NO3-+8Al+5OH-+2H2O$\stackrel{△}{→}$3NH3+8AlO2-,根据以上的实验操作与现象,该同学得出的结论不正确的是( )

己知:3NO3-+8Al+5OH-+2H2O$\stackrel{△}{→}$3NH3+8AlO2-,根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 试样中肯定存在NH4+、Mg2+、SO42-和NO3- | |
| B. | 该雾霾中可能存在NaNO3、NH4Cl和MgSO4 | |
| C. | 试样中可能存在Na+、Cl- | |
| D. | 试样中一定不含Al3+ |
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极.接通电源,经过一段时间后,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极.接通电源,经过一段时间后,乙中c电极质量增加.据此回答问题: ,
, ,用电子式表示C2B的形成过程
,用电子式表示C2B的形成过程