题目内容
10.关于下列图示的说法中,正确的是( )
| A. | 图④装置可以用来除去SO2中的HCl | |
| B. | 用图②所示实验装置排空气法收集CO2气体 | |
| C. | 图③表示可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H大于0 | |
| D. | 图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
分析 A.SO2、HCl均与NaOH溶液反应;
B.二氧化碳的密度比空气密度大,利用向上排空气法收集;
C.图中反应物总能量大于生成物总能量;
D.发生强酸制取弱酸的反应,可知酸性硫酸>碳酸>硅酸.
解答 解:A.SO2、HCl均与NaOH溶液反应,则试剂不合理,应为饱和亚硫酸氢钠溶液,故A错误;
B.二氧化碳的密度比空气密度大,利用向上排空气法收集,则图中气体应从长导管进入,故B错误;
C.图中反应物总能量大于生成物总能量,为放热反应,而CO(g)+H2O(g)?CO2(g)+H2(g)的△H大于0,二者不符,故C错误;
D.发生强酸制取弱酸的反应,可知酸性硫酸>碳酸>硅酸,由最高价含氧酸的酸性可知非金属性为S>C>Si,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、气体收集、能量变化及性质比较等,把握物质的性质、相关反应原理为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列离子方程式书写正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++OH-+H2↑ | |
| B. | 铁与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
1. 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应:

(1)已知:
计算上述反应的△H=+124 kJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度 600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为 600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用.
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应:
(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol?1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度 600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为 600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用.
15.25℃时,某一元弱酸HA的电离平衡常数为Ka,A?的水解平衡常数为Kh,该温度下向20mL 0.lmol•L-1 HA溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略反应导致的温度变化).下列说法不正确的是( )

| A. | 滴定过程中总是存在:Ka>Kh | |
| B. | 点②所示溶液中存在:c(Na+)=c(A-) | |
| C. | 点③所示溶液中存在:c(Na+)=c(A-)+c(HA) | |
| D. | 向点①所示溶液中加水:$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$比值减小 |
2.关于Na+和Na的性质叙述正确的是( )
| A. | 都具有金属光泽 | B. | 都是强还原剂 | ||
| C. | 焰色反应现象相同 | D. | 电子层结构相同 |
19.填写溴、碘在不同溶剂中的颜色
| 水 | CCl4 | 汽油(苯) | |
| Cl2 | 黄绿色 | 黄绿色 | 黄绿色 |
| Br2 | 橙红色 | ||
| I2 | 紫红色 |
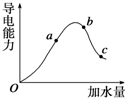 在25℃时,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
在25℃时,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: