题目内容
2.关于Na+和Na的性质叙述正确的是( )| A. | 都具有金属光泽 | B. | 都是强还原剂 | ||
| C. | 焰色反应现象相同 | D. | 电子层结构相同 |
分析 A.钠离子不具有金属光泽;
B.依据元素化合价判断氧化性、还原性;
C.焰色反应为元素性质;
D.钠离子有2个电子层,钠原子有3个电子层.
解答 解:A.钠离子不具有金属光泽,钠单质具有金属光泽,故A错误;
B.钠离子处于最高正价,只具有氧化性,钠单质中钠为0价,只能升高,具有强的还原性,故B错误;
C.钠离子与钠单质都含有钠元素,焰色反应都是黄色,故C正确;
D.钠离子有2个电子层,钠原子有3个电子层,二者电子层结构不同,故D错误;
故选:C.
点评 本题考查了元素化合物知识,明确钠及钠离子的性质是解题关键,注意焰色反应为元素物理性质,题目难度不大.

练习册系列答案
相关题目
10.关于下列图示的说法中,正确的是( )
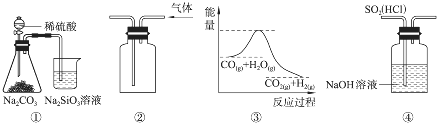

| A. | 图④装置可以用来除去SO2中的HCl | |
| B. | 用图②所示实验装置排空气法收集CO2气体 | |
| C. | 图③表示可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H大于0 | |
| D. | 图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
17.某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
(1)实验过程中,使用分液漏斗滴加液体的操作是打开分液漏斗上口的活塞(或将活塞上的凹槽与瓶口上的小孔对齐),旋开分液漏斗的旋塞,缓慢滴加.
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”).
(3)实验Ⅲ烧瓶中产生的SO2气体通入溴水溶液中发生反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-.
(4)实验Ⅱ中量气管中的液体最好是c(填字母编号,下同).
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理.图2各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF.
(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,②使量气管两端液面相平,③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
根据上述数据,可计算出镁铝合金中铝的质量分数为27.0%.
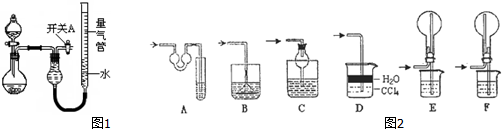
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | Na2SO3固体、浓H2SO4 | SO2 | |
| Ⅳ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”).
(3)实验Ⅲ烧瓶中产生的SO2气体通入溴水溶液中发生反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-.
(4)实验Ⅱ中量气管中的液体最好是c(填字母编号,下同).
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理.图2各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF.
(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,②使量气管两端液面相平,③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |

7.下列离子方程式的书写中正确的是( )
| A. | 等体积、等浓度的KHSO4溶液与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 在次氯酸中加入碳酸钠:2HClO+CO32-═2ClO-+H2O+CO2↑ | |
| C. | 钾与水反应:2K+2H2O═2K++2OH-+H2↑ | |
| D. | 氯化钠溶液中通入氟气:F2+2Cl-═2F-+Cl2↑ |


 .
. .
. .
.