题目内容
9.下列晶体熔化时不需破坏化学键的是( )| A. | 晶体硅 | B. | 食盐 | C. | 金属钾 | D. | 蔗糖 |
分析 根据熔化时不需要破坏化学键的是分子晶体,原子晶体、离子晶体、金属晶体熔化时需要破坏化学键,以此来分析.
解答 解:A、晶体硅是原子晶体,熔化需要破坏共价键,故A错误;
B、食盐晶体属于离子晶体,熔化时破坏离子键,故B错误
C、金属钾属于金属晶体,熔化时破坏金属键,故C错误;
D、蔗糖熔化时破坏分子间作用力,而不是化学键,故D正确;
故选D.
点评 本题考查化学键与晶体类型,难度不大,掌握常见物质的晶体类型是解题的关键.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
19.下列关于有机化合物的说法正确的是( )
| A. |  的名称为2-甲基-1-丙醇 的名称为2-甲基-1-丙醇 | B. | 氯乙烯和聚乙烯均能发生加成反应 | ||
| C. | C3H6Cl2有4种同分异构体 | D. |  分子中所有碳原子一定共平面 分子中所有碳原子一定共平面 |
20.下列表示物质或微粒的化学用语或模型正确的是( )
| A. | 中子数为8的碳原子:${\;}_{6}^{8}$C | B. | S2-的结构示意图: | ||
| C. | 二氧化碳电子式: | D. | 氮气的结构式:N-N |
17.关于下列物质的用途的说法错误的是( )
| A. | 乙二醇可用于配制汽车防冻液 | |
| B. | 部分卤代烃可用作灭火剂 | |
| C. | 酚类化合物有毒,不能用于杀菌消毒 | |
| D. | 甲醛的水溶液(福尔马林)可用于防腐 |
14.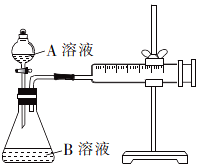 草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.
草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.
【实验设计】
甲组方案:通过测定生成CO2气体体积的方法来比较反应速率的大小.实验装置如图所示,25℃时将装置中的A溶液一次性加入B溶液(均已加入等量硫酸酸化)中.
(1)该反应中氧化剂和还原剂的物质的量之比为2:5.
(2)该实验探究的是H2C2O4的浓度对反应速率的影响.实现该实验目的还欠缺的仪器:秒表.比较①、②两组化学反应速率大小的方法是测定相同时间内收集到的气体体积(或者测定收集相同体积气体所用的时间.
乙组方案:用4mL0.0l mol/L酸性KMnO4溶液与2mL 0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.具体实验如下:
(3)若要研究催化剂对化学反应速率的影响,则应对比实验Ⅰ、Ⅱ(填序号,下同);若要研究温度对化学反应速率的影响,则应对比实验Ⅰ、Ⅲ.
(4)对比实验I和实验Ⅳ,可以研究硫酸的浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保两组实验中c(KMnO4)、c(H2C2O4)浓度不变和总体积不变.
 草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.
草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平).甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响.【实验设计】
甲组方案:通过测定生成CO2气体体积的方法来比较反应速率的大小.实验装置如图所示,25℃时将装置中的A溶液一次性加入B溶液(均已加入等量硫酸酸化)中.
| 实验编号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
| ② | 2mL 0.2mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
(2)该实验探究的是H2C2O4的浓度对反应速率的影响.实现该实验目的还欠缺的仪器:秒表.比较①、②两组化学反应速率大小的方法是测定相同时间内收集到的气体体积(或者测定收集相同体积气体所用的时间.
乙组方案:用4mL0.0l mol/L酸性KMnO4溶液与2mL 0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.具体实验如下:
| 实验编号 | 10%硫酸的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | - |
| Ⅱ | 2 | 20 | 少量MnSO4粉末 |
| Ⅲ | 2 | 30 | - |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
(4)对比实验I和实验Ⅳ,可以研究硫酸的浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保两组实验中c(KMnO4)、c(H2C2O4)浓度不变和总体积不变.
1.“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O═2Mg(OH)2.下列关于该电池的说法错误的是( )
| A. | 活性炭作为负极 | |
| B. | 食盐水作为电解质溶液 | |
| C. | 电池工作时O2得到电子 | |
| D. | 电池工作时实现了化学能向电能的转化 |
18.X、Y、Z为短周期元素,原子序数依次增大.X原子最外层电子数是Y原子最外层电子数的2倍,质子数比Y少5,X和Z在同一主族.下列叙述不正确的是( )
| A. | 原子半径:Y>Z | |
| B. | X元素的一种单质可用于消毒杀菌 | |
| C. | Y的单质在空气中放置表面易生成一层致密的氧化膜 | |
| D. | Z的单质在氧气中点燃可生成两种酸性氧化物 |
12.下列叙述中正确的是( )
| A. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| B. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| C. | 两原子,如果核外电子排布相同,则一定属于同种元素 | |
| D. | 阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
