题目内容
20.相等物质的量的SO2和SO3相比较,下列结论不正确的是( )| A. | 它们的分子数目之比为1:1 | B. | 它们所含氧原子数目之比为2:3 | ||
| C. | 它们所含原子数目之比为3:4 | D. | 它们的质量之比为1:1 |
分析 A.根据N=nNA可知,物质的量相同时,分子数之比等于物质的量之比;
B.根据N=nNA可知,物质的量相同时,分子数之比等于物质的量之比,再计算氧原子数之比;
C.根据N=nNA可知,物质的量相同时,分子数之比等于物质的量之比,再计算原子数之比;
D.根据m=nM可知,物质的量相同时,质量之比等于物质的摩尔质量之比.
解答 解:A.等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,故A正确;
B.等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,1个SO2分子中含有2个氧原子,1个SO3分子中含有3个氧原子,则所含O原子数之比为(1×2):(1×3)=2:3,故B正确;
C.等物质的量的SO2和SO3分子数目之比等于物质的量之比=1:1,1个SO2分子中含有3个原子,1个SO3分子中含有4个原子,则原子总数之比为(1×3):(1×4)=3:4,故C正确;
D.等物质的量的SO2和SO3质量之比等于物质的摩尔质量之比=64:80=4:5,故D错误;
故选D.
点评 本题考查阿伏伽德罗定律及推论的应用,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数等之间的关系即可解答,试题侧重基础知识的考查,有利于培养学生的化学计算能力.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
11.将1-氯丙烷跟NaOH的醇溶液共热后,生成的产物再跟溴水反应,得到的该有机物是 ( )
| A. | CH3-CH2-CHBr2 | B. |  | C. |  | D. |  |
15.某物质灼烧时,焰色反应为黄色,下列判断中正确的是( )
| A. | 该物质中一定只含钠元素 | B. | 该物质一定含钠元素,没有钾元素 | ||
| C. | 不能确定该物质中是否含钾元素 | D. | 该物质一定是金属钠 |
5.下列离子方程式中,正确的是( )
| A. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O | |
| C. | 足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O=2HCO3- | |
| D. | 向NaClO溶液中通入少量SO2:2ClO-+H2O+SO2=SO32-+2HClO |
9.水热法制备纳米化合物Y的反应为:3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O,下列说法中不正确的是( )
| A. | a=4 | |
| B. | S2O32-是氧化剂 | |
| C. | Y的化学式为Fe3O4 | |
| D. | 当有1molO2参加反应时,转移电子的物质的量为4 mol |
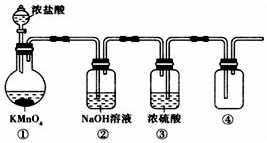 高锰酸钾(KMnO4)与浓盐酸不需加热就能发生反应产生Cl2.若用如图所示的实验装置制备纯净、干燥的Cl2,其中有错误的装置是( )
高锰酸钾(KMnO4)与浓盐酸不需加热就能发生反应产生Cl2.若用如图所示的实验装置制备纯净、干燥的Cl2,其中有错误的装置是( )