题目内容
9.水热法制备纳米化合物Y的反应为:3Fe2++2S2O32-+O2+aOH-═Y+S4O62-+2H2O,下列说法中不正确的是( )| A. | a=4 | |
| B. | S2O32-是氧化剂 | |
| C. | Y的化学式为Fe3O4 | |
| D. | 当有1molO2参加反应时,转移电子的物质的量为4 mol |
分析 从电荷守恒的角度分析,6-4-a=-2,所以a=4.可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Y+S4O62-+2H2O,根据铁元素和氧元素守恒,可知Y为Fe3O4,所以该离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O.
A、根据电荷守恒计算a的值;
B、根据S元素的化合价分析;
C、根据铁元素和氧元素守恒,可知Y为Fe3O4;
D、当有1 molO2参加反应时,反应中只有O2中氧元素化合价降低,据此计算.
解答 解:从电荷守恒的角度分析,6-4-a=-2,所以a=4.可配平反应的离子方程式:3Fe2++2S2O32-+O2+4OH-═Y+S4O62-+2H2O,根据铁元素和氧元素守恒,可知Y为Fe3O4,所以该离子方程式为3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O.
A、从电荷守恒的角度分析,6-4-a=-2,所以a=4,故A正确;
B、反应中S元素的化合价从+2价升高到+2.5价,则S2O32-是还原剂,故B错误;
C、根据铁元素和氧元素守恒,可知Y为Fe3O4,故C正确;
D、当有1 molO2参加反应时,反应中只有O2中氧元素化合价降低由0价降低为-2价,所以转移电子数为4mol,故D正确.
故选:B.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
20.相等物质的量的SO2和SO3相比较,下列结论不正确的是( )
| A. | 它们的分子数目之比为1:1 | B. | 它们所含氧原子数目之比为2:3 | ||
| C. | 它们所含原子数目之比为3:4 | D. | 它们的质量之比为1:1 |
17.下列与电化学有关的工业生产中,说法正确的是( )
| A. | 粗铜电解精炼时,电解质溶液的组成和浓度均保持不变 | |
| B. | 铁制品上镀一定厚度的锌层,选用锌作阳极,镀件作阴极,含锌离子的溶液作电解液 | |
| C. | 电解氯化钠溶液可以制备金属钠 | |
| D. | 氯碱工业中,电解饱和食盐水时,阳极上产生Cl2和NaOH |
14.下列说法正确的是( )
| A. | 固体氯化钠不导电,所以氯化钠是非电解质 | |
| B. | 铜丝能导电,所以铜是电解质 | |
| C. | 氯化氢水溶液能导电,氯化氯是电解质 | |
| D. | SO2的水溶液能导电,所以SO2是电解质 |
1.下列对氯及其化合物的说法正确的是( )
| A. | 用pH试纸能测得氯水的pH=4 | |
| B. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1-100nm之间 | |
| C. | 所有的金属都是固态的 | |
| D. | 用平行光线照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
18.下列不能使紫色石蕊试液褪色的是( )
| A. | 新制氯水 | B. | 漂白粉的水溶液 | C. | 次氯酸钠溶液 | D. | 二氧化硫 |
18.用如图装置可以进行实验并达达到实验目的是( )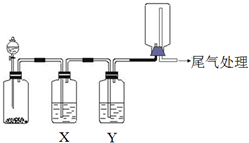

| 选项 | 实验目的 | X中试剂 | Y中 试剂 |
| A | 粗锌与稀盐酸制取 收集干燥的氢气 | 饱和食盐水 | 浓硫酸 |
| B | Na2SO3固体与较浓盐酸 反应制取收集干燥SO2 | 饱和Na2SO3溶液 | 浓硫酸 |
| C | 铜与稀硝酸制取并收集 纯净干燥的NO | 水 | 浓硫酸 |
| D | CaCO3和稀盐酸制取收集 纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |