题目内容
5.氯化亚铜(CuCl)广泛用于有机合成、气体吸收、冶金、医药化工等行业.(1)工业上氯化亚铜可由下列反应制备:
2CuSO4+Na2SO3+2NaCl+Na2CO3→2CuCl↓+3Na2SO4+CO2↑.制备过程中需要20%的CuSO4溶液,配制100g 该CuSO4溶液需要胆矾31.25g,需要水68.75g.
(2)实验室可用如下方法制备少量CuCl:取10mL 0.2mol/L CuCl2溶液,加入0.128g铜屑和36.5%的浓盐酸(密度为1.2g/mL)3mL,在密闭容器中加热,充分反应后,得到无色溶液A;将溶液A全部倾入水中,可得到白色的氯化亚铜沉淀.已知溶液A中只含氢离子和两种阴离子(不考虑水的电离),其中,n(H+)=0.036mol、n(Cl-)=0.032mol.请通过分析和计算,确定溶液A中另一阴离子的化学式和物质的量.
(3)由CO2、O2、CO、N2组成的混合气体1.008L,测得其密度为1.429g/L,将该气体依次通过足量的30%KOH溶液、氯化亚铜氨溶液(可完全吸收O2和CO)(假定每一步反应都能进行完全),使上述液体分别增加0.44g、0.44g(体积和密度均在标准状况下测定).
①该混合气体的摩尔质量是32g/mol;混合气体中n(CO2):n(CO和N2)=1:3.
列式计算:
②混合气体中CO的质量是多少?
③最后剩余气体的体积是多少?
分析 (1)20% 的CuSO4溶液含硫酸铜20g,根据胆矾的质量分数计算;
(2)溶液A中只含氢离子,说明铜元素形成了络合离子;溶液呈电中性,遵循电荷守恒;
(3)①摩尔质量等于密度乘以气体摩尔体积;KOH溶液可吸收二氧化碳,氯化亚铜氨溶液可完全吸收O2和CO;
②根据m=nM解题;
③剩余气体为氮气.
解答 解:(1)20% 的CuSO4溶液含硫酸铜20g,胆矾的质量为$\frac{20g×250}{160}$=31.25g,水的质量为100g-31.25g=68.75g,故答案为:31.25;68.75;
(2)溶液A中只含氢离子,说明铜元素形成了络合离子,为[CuCl2]-,溶液呈电中性,遵循电荷守恒,n(H+)=n(Cl-)+n[CuCl2]-,n[CuCl2]-=4×10-3mol,故答案为:①[CuCl2]-或[Cu2Cl4]2-;4×10-3mol或2×10-3mol(化学式须与物质的量匹配);
(3)①摩尔质量等于密度乘以气体摩尔体积,1.429g/L×22.4L/mol=32g/mol,混合气体的质量为1.429g/L×1.008L=1.4404g,1.4404g-0.44-0.44=0.5604g,n(N2)=$\frac{0.5604g}{28g/mol}$=0.02mol,
KOH溶液可吸收二氧化碳,n(CO2)=$\frac{0.44g}{44g/mol}$=0.01mol,混合气体的物质的量为$\frac{1.008L}{22.4mol/L}$=0.045mol,n(O2和CO)=0.045mol-0.01mol-0.02mol=0.015mol,
设CO的物质的量为x,氧气的物质的量为y.
x+y=0.015mol
28x+32y=0.44g
解得x=0.01mol,y=0.005mol
n(CO和N2)=0.01mol+0.02mol=0.03mol
n(CO2):n(CO和N2)=1:3,故答案为:32;1:3;
②m=nM=28g/mol×0.01mol=0.28g,答:质量为0.28g;
③剩余气体为氮气,体积是0.02mol×22.4L/mol,答:体积为0.448L.
点评 本题考查质量分数的计算、电荷守恒以及探究物质的组成或测量物质的含量,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,难度中等,注意相关基础知识的积累.

| A. | 氯水中:2c(Cl2)═c(ClO-)+c(Cl-)+c(HClO) | |
| B. | 25℃时,pH=12的NaOH溶液与pH=12的氨水;c(Na+)═c(NH4+) | |
| C. | pH=4的0.1 mol•L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| D. | 在K2CO3溶液中:c(CO32-)+c(H+)═c(HCO3-) |
| A. | 橡胶 | B. | 蛋白质 | C. | 油脂 | D. | 淀粉 |
| A. | 0.lmol氯气与铁反应,转移0.2NA电子 | |
| B. | 0.lmol过氧化钠与水反应,转移0.2NA电子 | |
| C. | 0.lmol铁与高温水蒸汽反应,转移0.3NA电子 | |
| D. | 0.lmol二氧化锰与足量浓盐酸反应,有0.4NA Cl-被氧化 |
| A. | K+、Na+、Cl-、NO3- | B. | Fe3+、K+、Br-、SCN- | ||
| C. | NH4+、Na+、CO32-、OH- | D. | Al3+、Mg2+、SO42-、HCO3- |
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B时△H=+119 kJ/mol 可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ | |
| D. | 在101kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,则H2在101kPa时的燃烧热为571.6kJ/mol |

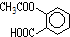 ,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
,则1mol阿斯匹林和足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol.
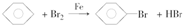 (催化剂也可以写FeBr3).
(催化剂也可以写FeBr3).