题目内容
下列物质A~K是中学化学常见的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;F极易液化,液化时放热;G在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如图甲所示的转化.
(1)I的化学式是 ,写出H→I的实验现象 .
(2)A与NaOH溶液反应的离子方程式是 .
(3)写出F→H转化的化学方程式是 ;该反应氧化剂与还原剂的物质的量之比是 ,当有15mol电子转移,则参加反应F的物质的量是 mol.
(4)写出D→K转化的离子方程式 .

(5)检验K中金属阳离子的常用试剂是 .
(6)①写出实验室制F的化学方程式是 ,实验室制备下列气体的实验装置可与制F相同的是 (填序号) a.O2 b.CO2 c.Cl2
②检验F的方法 .
③若用图乙所示制取少量F,下列可选用的试剂有 (填序号).
a.NaOH溶液 b.NaOH固体 c.浓氨水 d.熟石灰 e.浓硫酸 f.无水CuSO4 g.新制生石灰 h.碱石灰.
(1)I的化学式是
(2)A与NaOH溶液反应的离子方程式是
(3)写出F→H转化的化学方程式是
(4)写出D→K转化的离子方程式

(5)检验K中金属阳离子的常用试剂是
(6)①写出实验室制F的化学方程式是
②检验F的方法
③若用图乙所示制取少量F,下列可选用的试剂有
a.NaOH溶液 b.NaOH固体 c.浓氨水 d.熟石灰 e.浓硫酸 f.无水CuSO4 g.新制生石灰 h.碱石灰.
考点:无机物的推断
专题:推断题
分析:A、B均是常见的金属,且B的合金用量最大,则B为Fe,G在常温下是黄绿色气体,则G为Cl2,Fe与盐酸反应得到D为FeCl2,氯化亚铁与氯气反应得到K为FeCl3,K与铁反应生成氯化亚铁;金属A与盐酸反应得到C与氢气,C与NaOH反应得到白色沉淀,且白色沉淀能溶于NaOH溶液与稀盐酸,则A为Al、C为AlCl3、E为NaAlO2,F极易液化,液化时放热,J和氢气一定条件下反应,判断J为N2,F为NH3,H为NO,I为NO2;结合对应物质的性质以及题目要求解答该题.
解答:
解:A、B均是常见的金属,且B的合金用量最大,则B为Fe,G在常温下是黄绿色气体,则G为Cl2,Fe与盐酸反应得到D为FeCl2,氯化亚铁与氯气反应得到K为FeCl3,K与铁反应生成氯化亚铁;金属A与盐酸反应得到C与氢气,C与NaOH反应得到白色沉淀,且白色沉淀能溶于NaOH溶液与稀盐酸,则A为Al、C为AlCl3、E为NaAlO2,F极易液化,液化时放热,J和氢气一定条件下反应,判断J为N2,F为NH3,H为NO,I为NO2;结合对应物质的性质以及题目要求解答该题;
(1)由以上分析可知I为NO2,H→I的实验现象是无色气体变化为红棕色气体,
故答案为:NO2,无色气体变化为红棕色气体;
(2)A与NaOH溶液反应是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:
2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)F→H转化的化学方程式为:4NH3+5O2
4NO+6H2O;该反应氧化剂与还原剂的物质的量之比5:4;电子转移20mol,反应的氨气为4mol,当有15mol电子转移,则参加反应F的物质的量为3mol,
(4)反应D→K的离子方程式是为2Fe2++Cl2=2Fe3+,故答案为:2Fe2++Cl2=2Fe3+;
(5)K中金属阳离子为Fe3+,检验铁离子的常用试剂是KSCN溶液;
故答案为:KSCN溶液;
(6)①实验室制F为氨气的化学方程式是:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;实验室制备下列气体的实验装置可与制F相同的是固体和固体加热制备气体,a氧气和氨气制备装置相同;
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;a;
②检验F为NH3的方法为:用湿润的红色石蕊试纸检验氨气,氨气遇到湿润的红色石蕊指示剂变蓝色;
故答案为:用湿润的红色石蕊试纸检验氨气;
③若用图乙所示制取少量NH3,装置是常温下固体和液体混合发生反应生成,可选用的试剂有浓氨水,固体氢氧化钠、氧化钙、碱石灰,浓氨水滴入固体中溶解或反应放热使一水合氨分解生成氨气,制备得到氨气;
故答案为:bgh;
(1)由以上分析可知I为NO2,H→I的实验现象是无色气体变化为红棕色气体,
故答案为:NO2,无色气体变化为红棕色气体;
(2)A与NaOH溶液反应是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:
2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)F→H转化的化学方程式为:4NH3+5O2
| ||
| △ |
(4)反应D→K的离子方程式是为2Fe2++Cl2=2Fe3+,故答案为:2Fe2++Cl2=2Fe3+;
(5)K中金属阳离子为Fe3+,检验铁离子的常用试剂是KSCN溶液;
故答案为:KSCN溶液;
(6)①实验室制F为氨气的化学方程式是:2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
②检验F为NH3的方法为:用湿润的红色石蕊试纸检验氨气,氨气遇到湿润的红色石蕊指示剂变蓝色;
故答案为:用湿润的红色石蕊试纸检验氨气;
③若用图乙所示制取少量NH3,装置是常温下固体和液体混合发生反应生成,可选用的试剂有浓氨水,固体氢氧化钠、氧化钙、碱石灰,浓氨水滴入固体中溶解或反应放热使一水合氨分解生成氨气,制备得到氨气;
故答案为:bgh;
点评:本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,涉及Fe、Al、Cl元素单质化合物的性质,B的用途及转化关系特殊反应是推断突破口,难度不大,注意对基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法合理的是( )
| A、金属锂、镁在氧气中燃烧的产物分别为Li2O、Mg0 |
| B、H-F、H-O、H-N三个共价键的极性逐渐增强 |
| C、若X+和Y2-的核外电子层结构相同,则元素电负性X>Y |
| D、邻羟基苯甲醛沸点高于对羟基苯甲醛是因为形成了分子内氢键 |
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A、1.8g NH4+ 所含原子数为0.1NA |
| B、通常状况下,NA个CO2分子占有的体积为22.4 L |
| C、物质的量浓度为0.5mol/L的BaCl2溶液中,含有Cl- 个数为NA |
| D、1 mol?L-1的CaCl2溶液中,Cl-的物质的量浓度为2 mol?L-1 |
下列化学用语只能用来表示一种微粒的是( )
A、 |
B、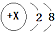 |
| C、CH4O |
| D、C |
下列关于物质分类的说法正确的是( )
| A、漂白粉、胆矾都属于混合物 |
| B、氧化铝、氯化钠都属于离子化合物 |
| C、氯化铵、次氯酸都属于强电解质 |
| D、二氧化硫、二氧化氮都属于酸性氧化物 |
常温下,浓度均为0.1mol/L CH3COOH溶液和HCN溶液的pH分别为m和n(1<m<n).下列叙述中不正确的是( )
| A、常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化小 |
| B、等温下,等浓度的CH3COONa和NaCN溶液pH,后者大 |
| C、HCN溶液和NaOH溶液不等体积混合后一定存在C(H+)-C(OH-)=C(CN-)-C(Na+) |
| D、溶液中由水电离出的c(H+),前者是后者的10m-n倍 |
