题目内容
14.已知R2+有b个中子,核外有a个电子,表示R原子符号正确的是( )| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b}$R |
分析 由R2+的电荷数可知R原子的电子数为a+2,原子的电子数等于质子数,再由“质子数+中子数=质量数”可得质量数为a+b+2,最后根据原子符号的含义来书写.
解答 解:因R2+的电荷数可知R原子的电子数为a+2,原子的电子数等于质子数,再由“质子数+中子数=质量数”可得质量数为a+b+2,所以R原子符号a+2a+b+2R,
故选C.
点评 本题的难点在于阳离子中核电荷数、核外电子数和离子所带电荷数的关系,注意基础知识的积累,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.用高铁酸钠(Na2FeO4)对河水、湖水消毒,是城市饮用水消毒的新技术.已知制备高铁酸钠的反应为Fe2O3+3Na2O2═2Na2FeO4+Na2O,下列说法正确的是( )
| A. | Na2O2 既是氧化剂,又是还原剂 | |
| B. | Fe2O3在反应中得到电子 | |
| C. | 3 mol Na2O2参加反应,转移的电子总数为12mol | |
| D. | Na2FeO4能消毒杀菌,因其具有强氧化性 |
9.下列化学用语正确的是( )
| A. | NaHCO3 的电离:NaHCO3═Na++H++CO32- | |
| B. | HS-的电离:HS-+H2O?H3O ++S2- | |
| C. | NaClO的电离:NaClO?Na++ClO- | |
| D. | NH4Cl水解方程式 NH4++H2O═NH3•H2O+H+ |
19.某主族元素R的最高正化合价与最低负化合价代数和为4,下列叙述正确的是( )
| A. | R一定是氧元素 | B. | R的最高价氧化物为RO2 | ||
| C. | R的气态氢化物很稳定 | D. | R可以形成多种含氧酸 |
3.可逆反应在一定条件下达到化学平衡时,下列说法不正确的是( )
| A. | 正反应速率等于逆反应速率 | B. | 各组分浓度不再发生变化 | ||
| C. | 反应体系中某组分的组成保持不变 | D. | 正、逆反应速率都为零 |
14.室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )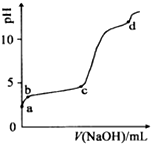

| A. | a点溶液呈酸性的原因是Al3+水解,离子方程为:Al3++3OH-?Al(OH)3 | |
| B. | c点铝元素主要以Al(OH)3的形式存在 | |
| C. | a-b段,溶液pH增大,Al3+浓度不变 | |
| D. | d点Al(OH)3沉淀开始溶解 |

 侧链上可能发生反应的类型:加成反应、氧化反应、还原反应、聚合反应等.(任填两种)
侧链上可能发生反应的类型:加成反应、氧化反应、还原反应、聚合反应等.(任填两种)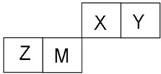 X、Y、Z、W四种短周期元素在周期表中的位置如右图,其中只有Z为金属元素.回答下列问题:
X、Y、Z、W四种短周期元素在周期表中的位置如右图,其中只有Z为金属元素.回答下列问题: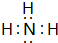 ,该气态氢化物可以用浓盐酸来检验,其反应产物的化学式为NH4Cl,所得产物中包含的化学键为离子键、共价键.
,该气态氢化物可以用浓盐酸来检验,其反应产物的化学式为NH4Cl,所得产物中包含的化学键为离子键、共价键.