题目内容
9.下列化学用语正确的是( )| A. | NaHCO3 的电离:NaHCO3═Na++H++CO32- | |
| B. | HS-的电离:HS-+H2O?H3O ++S2- | |
| C. | NaClO的电离:NaClO?Na++ClO- | |
| D. | NH4Cl水解方程式 NH4++H2O═NH3•H2O+H+ |
分析 A.碳酸氢根离子为多元弱酸的酸式根离子,不能拆;
B.硫氢根离子为多元弱酸的酸式根离子,部分电离生成硫离子和氢离子;
C.次氯酸钠为强电解质,完全电离,用等号;
D.铵根离子部分水解生成一水合氨和氢离子,水解为可逆反应,用可逆号.
解答 解:A.NaHCO3 为强电解质,完全电离,电离方程式:NaHCO3═Na++HCO3-,故A错误;
B.硫氢根离子为多元弱酸的酸式根离子,部分电离生成硫离子和氢离子,电离方程式HS-+H2O?H3O ++S2-,故B正确;
C.NaClO为强电解质,完全电离,电离的电离:NaClO=Na++ClO-,故C错误;
D.NH4Cl水解方程式:NH4++H2O?NH3•H2O+H+,故D错误;
故选:B.
点评 本题考查了电解质电离方程式、盐类水解离子方程式的书写,明确电解质强弱及电离方式是解题关键,注意可逆号、等号的使用,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
19. 已知下列数据:
已知下列数据:
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min;
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为在大试管中先加4 mL乙醇,再缓慢加入1 mL浓H2SO4,边加边振荡,待冷至室温后,再加4 mL乙酸并摇匀.
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)BC.
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是防止反应物随生成物一起大量被蒸出来,导致原料损失,及发生副反应.
(4)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)B.
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
(5)浓硫酸的作用是:①催化作用;②吸水作用.
(6)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止倒吸.
(7)若要把制得的乙酸乙酯分离出来,应采用的实验操作是用饱和碳酸钠溶液承接蒸馏出的乙酸乙酯,再分液.
(8)某同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是乙酸乙酯中含有乙酸,该过程中发生反应的化学方程式是CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O.
 已知下列数据:
已知下列数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.0 | 78.0 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10min;
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为在大试管中先加4 mL乙醇,再缓慢加入1 mL浓H2SO4,边加边振荡,待冷至室温后,再加4 mL乙酸并摇匀.
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)BC.
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是防止反应物随生成物一起大量被蒸出来,导致原料损失,及发生副反应.
(4)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)B.
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
(5)浓硫酸的作用是:①催化作用;②吸水作用.
(6)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止倒吸.
(7)若要把制得的乙酸乙酯分离出来,应采用的实验操作是用饱和碳酸钠溶液承接蒸馏出的乙酸乙酯,再分液.
(8)某同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是乙酸乙酯中含有乙酸,该过程中发生反应的化学方程式是CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O.
20.下列各组中,不管以何种比例混合,只要总质量一定,充分燃烧后生成的二氧化碳的量不变的是( )
| A. | 乙烯和苯 | B. | 乙醇和丙醇(CH3CH2CH2OH) | ||
| C. | 乙醇和乙醚(C2H5OC2H5) | D. | 甲醛(HCHO)和乙酸 |
17.下列不属于有机物的是( )
| A. |  | B. | C6H6 | C. | CCl4 | D. |  |
4.下列关于钠的化合物叙述中错误的是( )
| A. | 1 mol Na2O2与2 mol NaHCO3固体混合物在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是NaOH和Na2CO3 | |
| B. | 由Na2O、Na2O2、Na2CO3.10H2O组成的混合物0.05 mol,溶于水后加入50 mL 1 mol/L的硫酸恰好完全反应,则原混合物中各成分的物质的量之比可为任意值 | |
| C. | 将mg CO和H2的混合气体在足量氧气中完全燃烧,再将燃烧后的气体用足量Na2O2充分吸收,Na2O2增重mg | |
| D. | 将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是Na2O和Na2O2 |
14.已知R2+有b个中子,核外有a个电子,表示R原子符号正确的是( )
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b}$R |
1.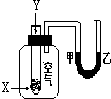 某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升.关于该反应的下列叙述:①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量部分转化为热量而释放出来.其中正确的是( )
某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升.关于该反应的下列叙述:①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量部分转化为热量而释放出来.其中正确的是( )
 某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升.关于该反应的下列叙述:①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量部分转化为热量而释放出来.其中正确的是( )
某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升.关于该反应的下列叙述:①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量部分转化为热量而释放出来.其中正确的是( )| A. | ①②③ | B. | ①③ | C. | ①② | D. | ②③ |
18.如图所示的实验,能达到实验目的是( )
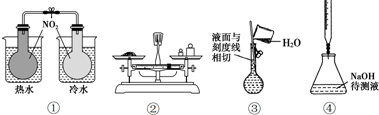

| A. | ①验证温度对平衡移动的影响 | B. | ②称量5.120gNaCl固体 | ||
| C. | ③配制一定物质的量浓度NaCl溶液 | D. | ④中和滴定 |
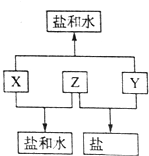 已知:A、B、C、D四种短周期元素,A与D原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,已知Z是常见的两性氢氧化物,试推断回答下列问题.
已知:A、B、C、D四种短周期元素,A与D原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,已知Z是常见的两性氢氧化物,试推断回答下列问题.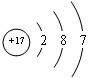 ;
;