题目内容
10.室温下,某溶液中由水电离出的c(H+)和c(OH-)的乘积是1.0×10-26,下列说法中正确的是( )| A. | 该溶液的溶质不可能是NaHSO4 | |
| B. | 向该溶液中加入铝粉,一定能产生大量H2 | |
| C. | 下列离子在该溶液中一定能大量共存:Cl-、K+、Cu2+ | |
| D. | 向该溶液中加入NaHCO3固体,一定有化学反应发生 |
分析 室温下,某溶液中由水电离出的c(H+)和c(OH-)的乘积是1.0×10-26,说明水的电离被抑制,此溶液可能是酸溶液,也可能是碱溶液,据此分析.
解答 解:室温下,某溶液中由水电离出的c(H+)和c(OH-)的乘积是1.0×10-26,说明水的电离被抑制,此溶液可能是酸溶液(或强酸的酸式盐溶液),也可能是碱溶液.
A、NaHSO4是强酸强碱盐,在溶液中能完全电离出钠离子、氢离子和硫酸根而显强酸性,对水的电离有抑制作用,故可能是NaHSO4溶液,故A错误;
B、此溶液可能是酸溶液(或强酸的酸式盐溶液),也可能是碱溶液,但如果是硝酸溶液,则加入铝无氢气产生,故B错误;
C、此溶液可能是酸溶液(或强酸的酸式盐溶液),也可能是碱溶液,但如果是碱溶液,则铜离子不能存在,故C错误;
D、此溶液可能是酸溶液(或强酸的酸式盐溶液),也可能是碱溶液,而NaHCO3和酸、碱均能反应,即一定有化学反应发生,故D正确.
故选D.
点评 本题考查了酸或碱对水的电离的抑制,难度不大,应注意的是在水中加入酸或碱,由由水电离出的c(H+)和c(OH-)的乘积变小,但水的离子积Kw不变.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.某抗瘤药物中间体的合成路线如下.下列说法正确的是( )

| A. | 吲哚不能使溴的四氯化碳溶液褪色 | |
| B. | 苯甲醛可发生加成、氧化和还原反应 | |
| C. | 可用银氨溶液鉴别苯甲醛和中间体 | |
| D. | 该中间体分子中含有2个手性碳原子 |
18.下列除杂方法错误的是( )
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤 | |
| B. | KNO3固体中混有少量NaCl:加H2O配制热的饱和溶液,再冷却结晶、过滤 | |
| C. | 乙醇中的少量水:加入适量新制的生石灰,加热蒸馏 | |
| D. | 二氧化碳中混有少量一氧化碳:点燃除去 |
5.有一瓶可能部分被氧化的Na2SO3溶液,某同学进行如下实验:取少量此溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀.下述有关此实验的结论正确的是( )
| A. | Na2SO3已部分被空气中的氧气氧化 | |
| B. | 加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 | |
| C. | 加硝酸后的白色沉淀不一定是BaSO4 | |
| D. | 此实验不能确定Na2SO3是否部分被氧化 |
 .
.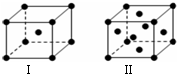 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2. ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③$\sqrt{2}$、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③$\sqrt{2}$、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.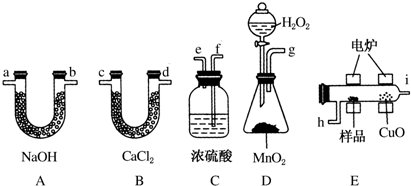
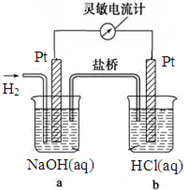 如图向a中通入H2,发现灵敏电流计指针发生偏转,持续通入H2可观察到b中铂电极表面有少量气泡产生,负极反应式为H2-2e-+2OH-=2H2O,电池的总反应为HCl+NaOH=H2O+NaCl.
如图向a中通入H2,发现灵敏电流计指针发生偏转,持续通入H2可观察到b中铂电极表面有少量气泡产生,负极反应式为H2-2e-+2OH-=2H2O,电池的总反应为HCl+NaOH=H2O+NaCl.