题目内容
15.元素周期表是学习物质结构和性质的重要工具,图1是元素周期表的一部分,表中所列序号①~⑧分别代表一种元素.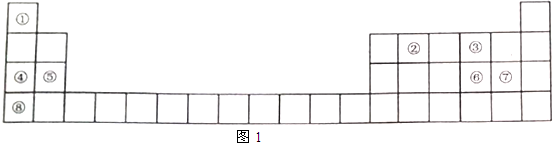
请用相应的元素符号或化学式回答下列问题.
(1)表中金属性最强的元素是K,③、④、⑤的原子半径由大到小的顺序是Na>Mg>O.
(2)①与②形成分子的空间结构可能是图2中的cd(填序号).

(3)①与⑦形成的化合物的电子式为
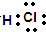 ,其中所含化学键的类型是共价键.
,其中所含化学键的类型是共价键.(4)④的最高氧化物对应的水化物是NaOH,它与少量⑥的一种氧化物反应的离子方程式是2OH-+SO2=SO32-+H2O.
分析 由元素在周期表的位置可知,①~⑧分别为H、C、O、Na、Mg、S、Cl、K,
(1)金属性最强的元素是K,电子层越多,原子半径越大,同周期从左向右原子半径减小;
(2)①与②形成分子的空间结构应满足C周围有4个共价键;
(3)①与⑦形成的化合物为HCl;
(4)④的最高氧化物对应的水化物是NaOH,⑥的一种氧化物可能为SO2,二者反应生成亚硫酸钠和水.
解答 解:由元素在周期表的位置可知,①~⑧分别为H、C、O、Na、Mg、S、Cl、K,
(1)金属性最强的元素是K,电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径为Na>Mg>O,
故答案为:K;
(2)①为H,②为C,由图可知,c为甲烷、d为苯,均满足C的成键要求,故答案为:cd;
(3)①与⑦形成的化合物为HCl,其电子式为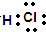 ,只含共价键,故答案为:
,只含共价键,故答案为: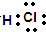 ;共价键;
;共价键;
(4)④的最高氧化物对应的水化物是NaOH,⑥的一种氧化物可能为SO2,二者反应生成亚硫酸钠和水,离子反应为2OH-+SO2=SO32-+H2O,
故答案为:NaOH;2OH-+SO2=SO32-+H2O.
点评 本题考查位置结构性质的相互关系应用,为高频考点,把握元素的位置、元素化合物知识为解答的关键,注意常见的有机物的结构,侧重分析与应用能力的考查,题目难度中等.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
5.下列有机物存在顺反异构的是( )
| A. | CH2=CH2 | B. | CH2=CHCH2CH3 | C. | CH3CH=CHCH3 | D. | CH3CH2OH |
6.下列有关日常生活中有机物的说法正确的是( )
| A. | 棉织物在灼烧时会产生烧焦羽毛的气味 | |
| B. | 氨基酸、淀粉、蛋白质均属于高分子化合物 | |
| C. | 将碘酒滴在土豆片上,可观察到土豆片变蓝色 | |
| D. | 利用油脂在酸性条件下的水解反应可以制取肥皂 |
3.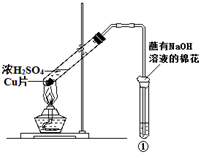 用如图所示装置进行实验,如表对实验现象及解释都正确的是( )
用如图所示装置进行实验,如表对实验现象及解释都正确的是( )
 用如图所示装置进行实验,如表对实验现象及解释都正确的是( )
用如图所示装置进行实验,如表对实验现象及解释都正确的是( )| ①中试剂 | ①中现象 | 解释 | |
| A | BaCl2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
| B | 滴加了酚酞的氢氧化钠溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
| D | 硫化氢溶液 | 溶液变浑浊 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
10.下列做法中,不利于实现“让太原天更蓝,水更清”目标的是( )
| A. | 减少汽车尾气排放 | B. | 推广使用脱硫煤 | ||
| C. | 推广使用无磷洗涤剂 | D. | 提倡使用含铅汽油 |
20.下列说法正确的是( )
| A. | 将苯和溴水混合后加入铁粉制取湨苯 | |
| B. | 检验溴乙烷中的湨元素的方法是加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| C. | 将硝酸银溶液加入到浓氨水中配成银氨溶液后,滴加几滴乙醛加热煮沸制银镜 | |
| D. | 蒸馏操作中,将温度计放置在蒸馏烧瓶支管口附近 |
7.“神舟七号”所用动力燃料之一为氢化锂“三兄弟”--LiH、LiD、LiT.有关LiH、LiD、LiT叙述正确的是( )
| A. | 质子数之比为1:2:3 | B. | 中子数之比为1:1:1 | ||
| C. | 摩尔质量之比为8:9:10 | D. | 化学性质不相同 |
4.下列事实的解释合理且表达正确的是( )
| A. | NH4Cl溶液呈酸性:NH4++2H2O?NH3•H2O+H3O+ | |
| B. | 氨气溶于水,溶液呈碱性:NH3•H2O═NH4++OH- | |
| C. | NaHSO4溶液可以导电:NaHSO4?Na++H++SO42- | |
| D. | 常温下,饱和H2CO3溶液pH=4:H2CO3?2H++CO32- |
5.下列说法正确的是( )
| A. | 在合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 | |
| B. | 锅炉中沉积的CaSO4可用饱和碳酸钠溶液浸泡,再用盐酸溶解而除去 | |
| C. | 将AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 | |
| D. | 加热Fe2(SO4)3溶液,Fe3+的水解程度和溶液的pH均增大 |