题目内容
3.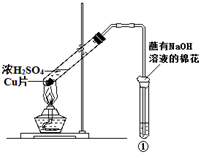 用如图所示装置进行实验,如表对实验现象及解释都正确的是( )
用如图所示装置进行实验,如表对实验现象及解释都正确的是( )| ①中试剂 | ①中现象 | 解释 | |
| A | BaCl2溶液 | 生成白色沉淀 | SO32-与Ba2+生成白色BaSO3沉淀 |
| B | 滴加了酚酞的氢氧化钠溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
| D | 硫化氢溶液 | 溶液变浑浊 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫不与氯化钡溶液反应,则不会生成白色沉淀;
B.二氧化硫为酸性氧化物,与氢氧化钠溶液发生中和反应;
C.二氧化硫能和水反应生成亚硫酸,亚硫酸电离出氢离子而使溶液呈酸性;
D.硫化氢与二氧化硫反应生成硫单质,二氧化硫表现了氧化性.
解答 解:A.BaCl2溶液不与二氧化硫发生反应,则①中不可能出现白色沉淀,故A错误;
B.滴加了酚酞的氢氧化钠溶液与二氧化硫发生中和反应,二氧化硫没有体现漂白性,故B错误;
C.二氧化硫能和水反应生成亚硫酸,亚硫酸电离出氢离子而使溶液呈酸性,酸遇石蕊试液变红色,故C正确;
D.二氧化硫与硫化氢反应生成S单质和水,该反应中二氧化硫被还原,则二氧化硫表现了氧化性,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,为高频考点,题目难度中等,明确实验原理及物质性质是解本题关键,注意二氧化硫不能漂白酸碱指示剂,为易错点,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
13. 一种具有很高比能量的新型干电池的工作原理如图所示:放电时的电极反应式之一为MnO2+e-+H2O═MnO(OH)+OH-,下列说法正确的是( )
一种具有很高比能量的新型干电池的工作原理如图所示:放电时的电极反应式之一为MnO2+e-+H2O═MnO(OH)+OH-,下列说法正确的是( )
 一种具有很高比能量的新型干电池的工作原理如图所示:放电时的电极反应式之一为MnO2+e-+H2O═MnO(OH)+OH-,下列说法正确的是( )
一种具有很高比能量的新型干电池的工作原理如图所示:放电时的电极反应式之一为MnO2+e-+H2O═MnO(OH)+OH-,下列说法正确的是( )| A. | 铝电极上的电极反应式:Al-3e-+3NH3•H20═Al(OH)3+3NH4+ | |
| B. | 电池工作时,NH4+、Na+移向铝电极 | |
| C. | 每消耗27g铝就会有3mol电子通过溶液转移到正极上 | |
| D. | 放电过程中正极附近溶液的PH减小 |
14.工业上可由乙苯生产苯乙烯: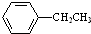 $→_{△}^{Fe_{2}O_{3}}$
$→_{△}^{Fe_{2}O_{3}}$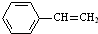 +H2,下列说法正确的是( )
+H2,下列说法正确的是( )
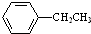 $→_{△}^{Fe_{2}O_{3}}$
$→_{△}^{Fe_{2}O_{3}}$ +H2,下列说法正确的是( )
+H2,下列说法正确的是( )| A. | 该反应的类型为消去反应 | |
| B. | 乙苯的同分异构体共有三种 | |
| C. | 可用酸性高锰酸钾溶液鉴别乙苯和苯乙烯 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数均为7 |
11.下列化合物中,含有共价键的离子化合物是( )
| A. | CaCl2 | B. | O2 | C. | H2O | D. | NH4NO3 |
8.下列对部分化学知识的归纳完全正确的一组是( )
| A. | 化学与生活 ①生活中常用加热煮沸的方法软化硬水 ②用燃烧的方法区分羊毛和涤纶 ③干冰用于人工降雨 | |
| B. | 化学与环境 ①焚烧植物秸秆不会造成空气污染 ②PM2.5是造成雾霾天气的元凶之一 ③含磷洗涤剂的使用会导致水污染 | |
| C. | 化学与安全 ①炒菜油锅着火可以用锅盖盖灭 ②在室内放一盆水,可防止煤气中毒 ③夜间发现液化气泄漏开灯寻找泄漏源 | |
| D. | 化学与健康 ①人体缺铁会引起贫血 ②用甲醛的水溶液浸泡海产品保鲜 ③食用蔬菜和水果来补充维生素 |
12.下列反应属于取代反应是( )
| A. | 2KI+Cl2═2KCl+I2 | B. | C2H5Cl+H2O C2H5OH+HCl C2H5OH+HCl | ||
| C. | nCH2═CH2$\stackrel{催化剂}{→}$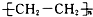 | D. | 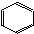 +3H2$→_{△}^{催化剂}$ +3H2$→_{△}^{催化剂}$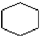 |
13.下列做法错误的是( )
| A. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| B. | 向试管中滴加液体时,胶头滴管不能伸入试管 | |
| C. | 将FeCl3饱和溶液滴入热的稀氢氧化钠溶液中制备氢氧化铁胶体 | |
| D. | 金属钠着火时,用干燥的沙土覆盖灭火 |
 ;②当转移2mol电子时,可得到还原产物58.5g.
;②当转移2mol电子时,可得到还原产物58.5g.

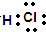 ,其中所含化学键的类型是共价键.
,其中所含化学键的类型是共价键.