题目内容
7.“神舟七号”所用动力燃料之一为氢化锂“三兄弟”--LiH、LiD、LiT.有关LiH、LiD、LiT叙述正确的是( )| A. | 质子数之比为1:2:3 | B. | 中子数之比为1:1:1 | ||
| C. | 摩尔质量之比为8:9:10 | D. | 化学性质不相同 |
分析 Li的质量数为7,质子数为3,故中子数=7-3=4;H、D、T的质子数都是1,中子数分别为0、1、2,质量数=质子数+中子数,质量数之比等于摩尔质量之比,利用组成和结构来分析物质的化学性质.
解答 解:Li的质量数为7,质子数为3,故中子数=7-3=4;
A.LiH的质子数为3+1=4,LiD的质子数为3+1=4,LiT的质子数为3+1=4,故三种物质的质子数之比为1:1:1,故A错误;
B.LiH的中子数为4,LiD的中子数为4+1=5,LiT的中子数为4+2=6,故三种物质的中子数之比为4:5:6,故B错误;
C.LiH的摩尔质量为7+1=8,LiD的摩尔质量为7+2=9,LiT的摩尔质量为7+3=10,故三种物质的摩尔质量之比为8:9:10,故C正确;
D.LiH、LiD、LiT的组成元素相同,结构相同,则三种物质的化学性质相同,故D错误;
故选C.
点评 本题考查原子内粒子间的数量关系,难度不大,要注意质量数=质子数+中子数,质子数=电子数.

练习册系列答案
相关题目
17.下列关于元素周期表的说法正确的是( )
| A. | 第IA族的所有元素都是金属元素 | |
| B. | 同周期主族元素中,第ⅦA族元素原子半径最小 | |
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 | |
| D. | -般在元素周期表的金属与非金属分界线附近寻找一些化学反应新型催化剂 |
2.下列芳香烃的一氯取代物的同分异构体数目最多的是( )
| A. | 连二苯 | B. | 菲 | C. | 蒽 | D. | 连三苯 |
12.下列反应属于取代反应是( )
| A. | 2KI+Cl2═2KCl+I2 | B. | C2H5Cl+H2O C2H5OH+HCl C2H5OH+HCl | ||
| C. | nCH2═CH2$\stackrel{催化剂}{→}$ | D. |  +3H2$→_{△}^{催化剂}$ +3H2$→_{△}^{催化剂}$ |
17.乙烷与氯气的取代反应中,最多有几种有机产物?( )
| A. | 6种 | B. | 7 种 | C. | 8种 | D. | 9种 |
 ;②当转移2mol电子时,可得到还原产物58.5g.
;②当转移2mol电子时,可得到还原产物58.5g.

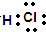 ,其中所含化学键的类型是共价键.
,其中所含化学键的类型是共价键.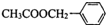 )对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业.乙酸苯甲酯的合成路线如下:
)对花香和果香的香韵具有提升作用,故常用于化妆品和食品工业.乙酸苯甲酯的合成路线如下: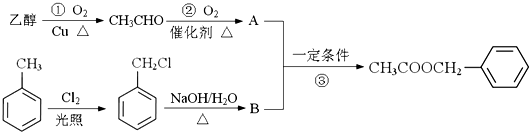
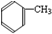 制备
制备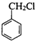 C.2CH3CHO+O2$\underset{\stackrel{催化剂}{→}}{△}$2A
C.2CH3CHO+O2$\underset{\stackrel{催化剂}{→}}{△}$2A