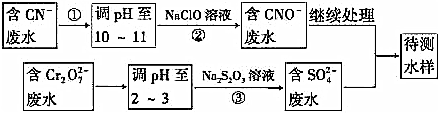
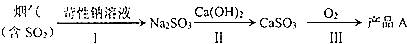题目内容
4.下列实验操作,能达到实验目的是( )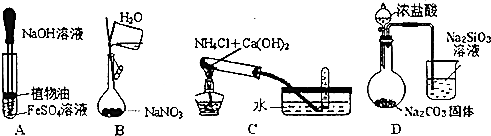
| A. | 观察Fe(OH)2的生成 | |
| B. | 配置1mol•L-1的NaNO3溶液 | |
| C. | 实验室制取氨气 | |
| D. | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
分析 A.Fe(OH)2易被空气中的氧气氧化;
B.容量瓶不能溶解物质;
C.氨气极易溶于水;
D.盐酸易挥发,不能排除盐酸的干扰.
解答 解:A.Fe(OH)2易被空气中的氧气氧化,植物油可隔绝空气,故A正确;
B.容量瓶不能溶解物质,应现在小烧杯中溶解,故B错误;
C.氨气极易溶于水,不能用排水法收集,故C错误;
D.盐酸易挥发,不能排除盐酸的干扰,应先通过饱和碳酸氢钠除去二氧化碳中的氯化氢,故D错误.
故选A.
点评 本题考查较为综合,涉及物质的性质对比、除杂等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握实验的原理和实验操作的严密性和可行性的评价,难度中等.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
14.下列物质属于两性氧化物的是( )
| A. | CaO | B. | S02 | C. | A1203 | D. | A1(0H)3 |
15.下列溶液中各微粒的浓度关系正确的是( )
| A. | 室温下,pH>7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+) | |
| B. | 将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)=c(Cl-) | |
| C. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH${\;}_{4}^{+}$)=c(K+)=c(Ba2+) | |
| D. | 0.2mol•L-1某一元弱酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA) |
12. 为验证铜与稀硝酸反应的还原产物是NO而不是NO2.某同学设计了如图所示的装置,下列叙述错误的是( )
为验证铜与稀硝酸反应的还原产物是NO而不是NO2.某同学设计了如图所示的装置,下列叙述错误的是( )
 为验证铜与稀硝酸反应的还原产物是NO而不是NO2.某同学设计了如图所示的装置,下列叙述错误的是( )
为验证铜与稀硝酸反应的还原产物是NO而不是NO2.某同学设计了如图所示的装置,下列叙述错误的是( )| A. | 应先打开活塞和旋塞再从U型管右侧加入稀硝酸 | |
| B. | 加入的稀硝酸应充满U型管左侧 | |
| C. | 关闭旋塞后铜丝会全部溶解 | |
| D. | 反应停止后打开活塞,气体变成红棕色 |
19.下列说法不正确的是( )
| A. | HNO3、NaOH、BaSO4均属于电解质 | |
| B. | SO2、NO2、CO2均能形成酸雨 | |
| C. | NH4HCO3、NH4Cl、I2受热后均无固体剩余 | |
| D. | FeCl2、NaHSO3、Fe(OH)3均能通过化合反应直接制得 |
3.下列说法不正确的是( )
| A. | 恒温恒容容器中发生反应C(s)+H2O(g)?CO(g)+H2(g),当混合气体密度不变时反应达到平衡 | |
| B. | 平衡向右移动时,反应物的转化率一定增大,平衡常数不一定增大 | |
| C. | 恒温时向BaSO4悬浊液中加入Na2SO4固体,Ba2+浓度减小,溶度积KsP (BaSO4)不变 | |
| D. | 向氨水中逐滴加入盐酸,溶液呈中性时离子浓度为:c(Cl-)═c(NH4+)>c(H+)=c(OH-) |
4.某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素.实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010mol•L-1、0.0010mol•L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.10mol•L-1)的用量均为2mL.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(2)某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
①实验②中用KMnO4的浓度变化来表示的平均反应速率为1×10-4mol•L-1•min-1(忽略混合前后溶液的体积变化).
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确否(填“是”或“否”).他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行否(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液,分别同时与体积相同、浓度相同的酸性高锰酸钾溶液反应.
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验 编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究温度对该反应速率的影响; c.实验①和④探究催化剂对该反应速率的影响. |
| ② | 298 | 0.5 | 0.0010 | |
| ③ | 323 | 0.5 | 0.010 | |
| ④ | 298 | 0 | 0.010 |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| ① | 14.0 | 13.0 | 11.0 |
| ② | 6.0 | 7.0 | 7.0 |
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确否(填“是”或“否”).他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行否(填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:取过量的体积相同、浓度不同的草酸溶液,分别同时与体积相同、浓度相同的酸性高锰酸钾溶液反应.