题目内容
15.下列电离方程式书写错误的是( )| A. | H2SO4→2H++SO42- | B. | NaHCO3→Na++HCO3- | ||
| C. | KClO3→K++Cl-+3O2- | D. | HAc?H++Ac- |
分析 离子所带电荷数一般可根据它们在化合物中的化合价来判断,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,离子团不能拆开,结合电解质的强弱分析.
解答 解:A.H2SO4是强电解质,能完全电离,电离方程式为H2SO4→2H++SO42-,故A正确;
B.碳酸氢钠是强电解质,能完全电离出钠离子和碳酸氢根离子,碳酸氢根离子团不能拆开,电离方程式为NaHCO3→Na++HCO3-,故B正确;
C.KClO3是强电解质,能完全电离,电离出钾离子和氯酸根离子,电离方程式为KClO3→K++ClO3-,故C错误;
D.HAc是弱电解质,在溶液中部分电离,它的电离方程式为:HAc?H++Ac-,故D正确;
故选C.
点评 本题考查电离方程式的书写,明确书写电离方程式的方法,并会正确判断不可拆分的原子团是解题的关键所在,难度不大.

练习册系列答案
相关题目
5.已知同温同压下,下列反应的焓变和平衡常数分别表示为
(1)2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1 K1=a
(2)2NO(g)+O2(g)?2NO2(g)△H2=-144kJ•mol-1 K2=b
(3)NO2(g)+SO2(g)?SO3(g)+NO(g)△H3=-m kJ•mol-1 K3=c
下列说法正确的是( )
(1)2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1 K1=a
(2)2NO(g)+O2(g)?2NO2(g)△H2=-144kJ•mol-1 K2=b
(3)NO2(g)+SO2(g)?SO3(g)+NO(g)△H3=-m kJ•mol-1 K3=c
下列说法正确的是( )
| A. | m=53 c2=a/b | B. | m=-26.5 2c=a-b | C. | m=-170.5 2c=a-b | D. | m=26.5 c2=$\frac{a}{b}$ |
3.化学与生产生活密切相关.下列有关说法不正确的是( )
| A. | 电解法精炼铜时,可选择精铜做阳极,硫酸铜溶液为电解质溶液 | |
| B. | 煤油可由石油分馏获得,可用作燃料或保存少量金属钠 | |
| C. | 鲜榨的苹果汁在空气中极易被氧化,为防止其氧化可向其中加入维生素C.在这个过程中,维生素C发生了氧化反应 | |
| D. | 利用油脂在碱性条件下的水解,可制得肥皂 |
10.下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是( )
| A. | K+、MnO4-、Cl-、SO42- | B. | Na+、AlO2-、NO3-、CO32- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Na+、Ag+、NO3-、Cl- |
20.下列叙述中,不正确的是( )
| A. | 金刚石和石墨均为碳元素组成的单质 | |
| B. | FeCl3溶液和Fe(OH)3胶体的本质区别是分散质粒子的直径大小不同 | |
| C. | 硫酸、Na2CO3和CaO分别属于酸、碱和氧化物 | |
| D. | 通过化学反应,可由Ba(OH)2一步转化生成NaOH |
7.下列变化过程中,△S<0的是( )
| A. | 氯化钠溶于水 | B. | NH3(g)与HCl(g)反应生成NH4Cl(s) | ||
| C. | 干冰升华 | D. | 煅烧石灰石 |
4.在体积为V L的硫酸铝溶液中加入足量的氨水,过滤得沉淀,将沉淀洗净后灼烧至质量不再变化时冷却、称量,得mg白色固俸.原溶液中c(SO42-)为( )
| A. | $\frac{m}{V}$mol•L-1 | B. | $\frac{2m}{27V}$mol•L-1 | C. | $\frac{m}{18V}$mol•L-1 | D. | $\frac{m}{34V}$mol•L-1 |
14.如图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).
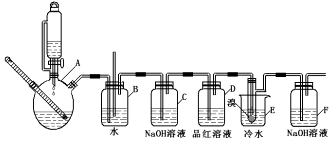
已知:
CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O
CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O
相关数据列表如表:
请完成下列填空:
(1)实验中应迅速将温度升高到170℃左右的原因是减少副产物乙醚生成.
(2)气体发生装置使用连通滴液漏斗的原因使连通滴液漏斗里的溶液容易滴下.
(3)安全瓶B在实验中有多重作用,其一可以检查实验进行中B后面的装置中导管是否发生堵塞,请写出发生堵塞时瓶B中的现象B中长直玻璃管内有一段液柱上升;
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽;
(5)容器C、F中都盛有NaOH溶液,F中NaOH溶液的作用是吸收挥发的溴蒸气;
(6)反应过程中用冷水冷却装置E不能过度冷却(如用冰水),其原因是过渡冷却1,2-二溴乙烷易凝结成固体而发生堵塞.
(7)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装置的气密性没有问题,试分析可能的原因:①浓硫酸将部分乙醇氧化②发生副反应生成乙醚③乙醇挥发④乙烯流速过快,未完全发生加成反应;(写出两条即可)
(8)除去产物中少量未反应的Br2后,还含有的主要杂质为乙醚,要进一步提纯,下列操作中必须用到的是D(填入正确选项前的字母);
A.重结晶 B.过滤 C.萃取 D.蒸馏.

已知:
CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O
CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O
相关数据列表如表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 | 3.10 |
| 沸点/℃ | 78.5 | 132 | 34.6 | 58.8 |
| 熔点/℃ | -l30 | 9 | -1l6 | -7.2 |
| 水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)实验中应迅速将温度升高到170℃左右的原因是减少副产物乙醚生成.
(2)气体发生装置使用连通滴液漏斗的原因使连通滴液漏斗里的溶液容易滴下.
(3)安全瓶B在实验中有多重作用,其一可以检查实验进行中B后面的装置中导管是否发生堵塞,请写出发生堵塞时瓶B中的现象B中长直玻璃管内有一段液柱上升;
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽;
(5)容器C、F中都盛有NaOH溶液,F中NaOH溶液的作用是吸收挥发的溴蒸气;
(6)反应过程中用冷水冷却装置E不能过度冷却(如用冰水),其原因是过渡冷却1,2-二溴乙烷易凝结成固体而发生堵塞.
(7)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装置的气密性没有问题,试分析可能的原因:①浓硫酸将部分乙醇氧化②发生副反应生成乙醚③乙醇挥发④乙烯流速过快,未完全发生加成反应;(写出两条即可)
(8)除去产物中少量未反应的Br2后,还含有的主要杂质为乙醚,要进一步提纯,下列操作中必须用到的是D(填入正确选项前的字母);
A.重结晶 B.过滤 C.萃取 D.蒸馏.
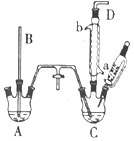 氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下:
氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取.反应原理、实验装置图(加热装置都已略去)如下: +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$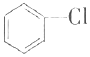 +HCl
+HCl